第Ⅲ相試験:VIEW1試験(海外データ)、
日本人を含む第Ⅲ相国際共同試験:VIEW2試験1-4)
(ラニビズマブに対する非劣性の検証)
1)バイエル薬品社内資料[海外第Ⅲ相試験:VIEW1試験(外国人)]承認時評価資料
2)バイエル薬品社内資料[日本人を含む第Ⅲ相国際共同試験:VIEW2試験]承認時評価資料
3)バイエル薬品社内資料[VIEW1、VIEW2試験併合解析、2年間]承認時評価資料
4)バイエル薬品社内資料[VIEW2試験日本人部分集団解析、2年間]承認時評価資料
本剤は海外で実施された第I相試験、第Ⅱ相試験の結果および海外第Ⅲ相試験、日本人を含む第Ⅲ相国際共同試験を基に承認されました。承認時に評価されたデータを紹介しますが、一部国内の承認内容と異なる用法及び用量が含まれています。
海外第Ⅱ相試験(CLEAR-IT Ⅱ試験)の結果から、アイリーア投与群として3つの用法及び用量(0.5mg4週ごと、2mg4週ごと、2mg8週ごと)を設定し、VIEW1試験とVIEW2試験の各々の結果により、アイリーアの有効性についてラニビズマブに対する非劣性を検証しました。
【実施地域】
VIEW1試験:米国およびカナダの2ヵ国、154施設
VIEW2試験:インド、アジア太平洋地域(日本含む)、オーストラリア、欧州連合、ラテンアメリカ、イスラエルの26ヵ国、186施設
試験概要
目的
中心窩下CNVを伴う滲出型AMD患者を対象として、アイリーアの有効性についてラニビズマブ0.5mg4週ごと投与に対する非劣性を検証するとともに、安全性および忍容性についても検討する
試験対象
中心窩下CNVを伴う滲出型加齢黄斑変性(AMD)患者2,457例
VIEW1試験:1,217例、VIEW2試験:1,240例(うち日本人:101例)
[主な選択基準]
- 試験眼において、FAにより確認されたAMDに伴う初発の中心窩下CNVの活動性病変(傍中心窩CNV病変を含む)を有する50歳以上の男女
- CNV病変面積が病変全体の50%以上
- 試験眼のETDRS視力表による最高矯正視力文字数が73~25文字(スネレン視力で20/40~20/320) など
[主な除外基準]
- 試験眼に、FAにより評価した総病変面積が12視神経乳頭面積(12視神経乳頭面積は30.5mm2とし、病変には出血、瘢痕、新生血管を含む)を超える
- 試験眼に、病的近視、眼ヒストプラズマ症候群、網膜色素線条、脈絡膜破裂または多巣性脈絡膜炎等の他の原因によるCNVを有する
- いずれかの眼に、糖尿病網膜症、糖尿病黄斑浮腫(DME)またはAMD以外の網膜に及ぶその他の血管性疾患を有する
- 試験眼にVEGF阻害剤による治療歴を有する など
試験デザイン
無作為化二重遮蔽実薬対照比較試験
投与方法
対象患者を、アイリーア2mg4週ごと投与群、0.5mg4週ごと投与群、2mg8週ごと投与群、およびラニビズマブ0.5mg4週ごと投与群の4群に無作為に割り付け、硝子体内投与を行った。治療開始時は全群4週ごと投与を3回連続行い、その後は各群の投与スケジュールに従い投与した(固定投与期)。
52週経過後は、各群ともに投与間隔を12週に1回を基本とし、再投与基準に合致した場合は、それ以前(4週あるいは8週)に投与できることとした(Modified Quarterly Dosing期)。

[Modified Quarterly Dosing期の再投与基準]
- OCTで中心網膜厚(CRT)がそれまでの最低値よりも100µm以上増加
- OCTで網膜の貯留液が認められ、かつ最高矯正視力文字数がそれまでの最高文字数から5文字以上低下
- OCTにより検出される新規または遷延性の網膜の貯留液
- 新たなclassic型新生血管
- FAにより検出される新規または遷延性の漏出性変化
- 新たな黄斑部の出血
- 前回の試験薬投与から12週間以上が経過
主な有効性評価項目
主要評価項目:
- 52週目に視力が維持(ETDRS視力表による最高矯正視力文字数の低下が15文字未満)された患者の割合
副次評価項目:
- 以下の項目の52週目におけるベースラインからの変化量(①最高矯正視力文字数、②視力が改善(最高矯正視力文字数が15文字以上増加)した患者の割合、③NEI VFQ-25合計スコア、④CNV病変面積)
追加評価項目:
- 中心網膜厚(CRT)の変化量 など
探索的評価項目:
- 96週目(2年目)終了時のすべての評価※1
主な安全性評価項目
有害事象、副作用、重篤な有害事象、投与中止に至った有害事象、死亡、APTC定義による動脈血栓塞栓事象 など
解析計画
検証的な解析(第1種の過誤を考慮し、検出力を考慮し例数設計された解析)
- 主要評価項目(PPS):アイリーア投与群のラニビズマブ投与群に対する非劣性の検証(限界値※210%)。検定の多重性を考慮し、事前に定めた順序(アイリーア2mg4週ごと投与群、アイリーア0.5mg4週ごと投与群、アイリーア2mg8週ごと投与群)に従い検定を行う。
第1種の過誤を考慮した解析(検出力を考慮した例数設計はされていない)
- 副次評価項目(FAS):アイリーア投与群のラニビズマブ投与群に対する優越性の検討。ただし、検定の多重性を考慮し、すべてのアイリーア投与群において、主要評価項目で非劣性が検証された場合に限り、事前に定めた順序(アイリーア2mg4週ごと投与群の①②③、アイリーア0.5mg4週ごと投与群の①②③、アイリーア2mg8週ごと投与群の①②③、各群の④)に従い検定を行う。
VIEW1試験:アイリーア2mg4週ごと投与群の②において優越性が示されなかったため、検定を終了した。
VIEW2試験:アイリーア2mg4週ごと投与群の①において優越性が示されなかったため、検定を終了した。
探索的な解析
- 追加評価項目(FAS)
- 探索的評価項目(FAS)
- 部分集団解析:VIEW2試験における日本人の部分集団解析 など
- *1
- 日本におけるラニビズマブの中心窩下脈絡膜新生血管を伴う加齢黄斑変性症に対する承認用法及び用量は「ラニビズマブ(遺伝子組換え)として0.5mg(0.05mL)を1ヵ月毎に連続3ヵ月間(導入期)硝子体内投与する。その後の維持期においては、症状により投与間隔を適宜調節するが、1ヵ月以上の間隔をあけること。」
- *2
- 固定投与期において、実薬投与時以外は偽注射投与を実施した。
CNV(choroidal neovascularization):脈絡膜新生血管
FA(fluorescein angiography):フルオレセイン蛍光眼底造影
OCT(optical coherence tomography):光干渉断層計
PPS(per protocol set):治験実施計画書に適合した患者集団
FAS(full analysis set):最大の解析対象集団
NEI VFQ-25(National Eye Institute 25-item Visual Function Questionnaire):米国国立眼病研究所の25項目からなる視覚機能についてのアンケート
- ※1
- VIEW2試験において、92週目に再投与が行われた患者では、100週目の結果を最終評価として用いた(CNV病変面積、NEI VFQ-25合計スコア、CRT)
- ※2
- VIEW1試験:両側95.1%信頼区間、VIEW2試験:両側95%信頼区間
中心窩下脈絡膜新生血管を伴う加齢黄斑変性の用法及び用量
アフリベルセプト(遺伝子組換え)として2mg(0.05mL)を1ヵ月ごとに1回、連続3回(導入期)硝子体内投与する。その後の維持期においては、通常、2ヵ月ごとに1回、硝子体内投与する。なお、症状により投与間隔を適宜調節するが、1ヵ月以上あけること。
試験対象例数と各群の患者の内訳

患者背景および特性(FAS)
VIEW1試験およびVIEW2試験において、各投与群のベースライン時の人口統計学的特性は以下の通りでした。
VIEW1試験
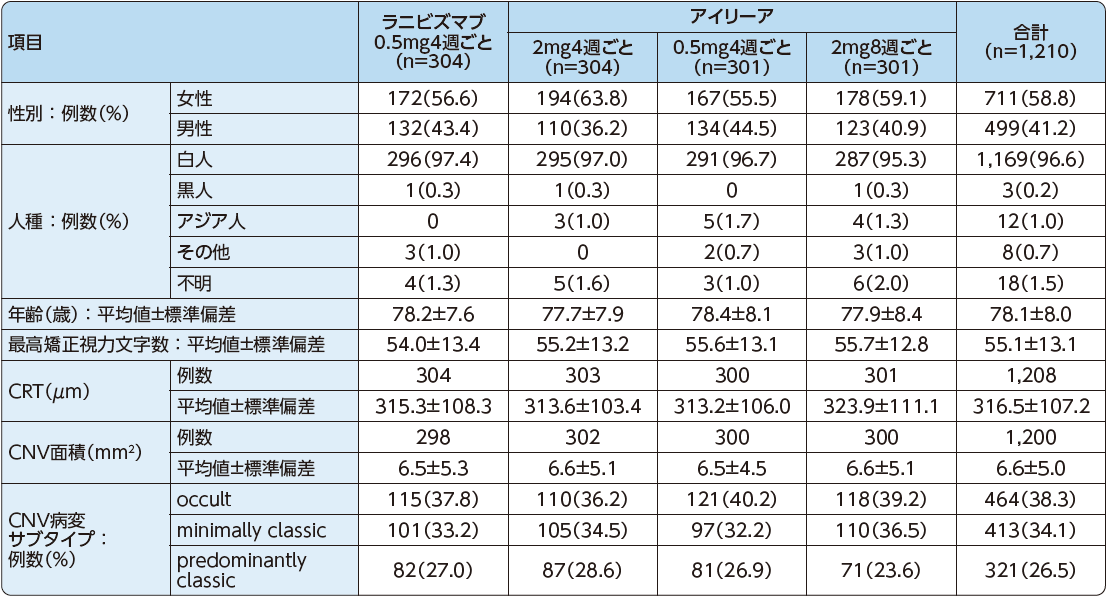
VIEW2試験

投与回数
52週目までに要した投与回数は、アイリーア2mg8週ごと投与群で7.5回、他の投与群では12.1~12.5回でした。
また、96週目までに要した投与回数においても、アイリーア2mg8週ごと投与群で11.1~11.3回、他の投与群では15.7~16.8回でした。
平均投与回数(安全性解析対象集団)
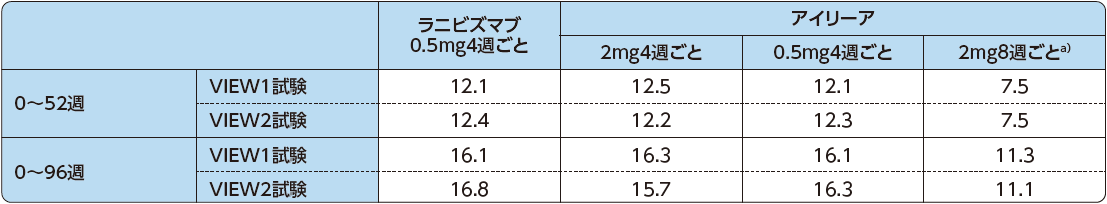
a)偽注射を除く投与回数
視力評価
(1)視力の維持
52週目に視力が維持※された患者の割合は、アイリーア2mg8週ごと投与群では、VIEW1試験およびVIEW2試験のいずれにおいても95%以上でした。ラニビズマブ投与群と各アイリーア投与群との差は、両側95.1%(VIEW1試験)または両側95%(VIEW2試験)信頼区間の上限値がいずれも3.1%以下であり、限界値の10%を下回ったことから、アイリーアのすべての投与群でラニビズマブに対する非劣性が検証されました。また、アイリーア投与群で96週目に視力を維持した患者割合は、90.0%~93.5%でした。
※ 視力の維持:ETDRS視力表による最高矯正視力文字数の低下が15文字未満
52週目(PPS)および96週目(FAS)に視力が維持された患者の割合(LOCF)

LOCF(last observation carried forward):最終評価スコア外挿法
52週目に視力が維持された患者の群間差(LOCF、PPS)

a)ラニビズマブ投与群-各アイリーア投与群(信頼区間は正規近似を用いた)
b)非劣性限界値10%
(2)最高矯正視力
VIEW1試験およびVIEW2試験における最高矯正視力文字数の変化量は、以下の通りに推移しました。
VIEW1試験では、52週目においてアイリーアの2mg4週ごと投与群(+10.9文字)でラニビズマブ投与群(+8.1文字)に対する有意差(p=0.0054:ANCOVA※)が認められ優越性が示されました。VIEW2試験では、52週目においてアイリーア2mg4週ごと投与群(+7.6文字)のラニビズマブ投与群(+9.4文字)に対する優越性が示されなかったため、事前に定めた順序に従った検定を終了しました。
※ 投与群を固定効果、最高矯正視力文字数を共変量としたANCOVAモデル
最高矯正視力文字数の変化量の推移(LOCF、FAS)

(3)視力の改善
VIEW1試験において、52週目に視力が改善※した患者の割合はラニビズマブ投与群で30.9%、アイリーア2mg4週ごと投与群では37.5%であり、ラニビズマブ投与群に対するアイリーア2mg4週ごと投与群の優越性が示されなかったため、事前に定めた順序に従った検定を終了しました。
※ 視力の改善:ETDRS視力表による最高矯正視力文字数の増加が15文字以上
52週目および96週目に視力が改善した患者の割合(LOCF、FAS)

QOLに関する評価
【参考情報】NEI VFQ-25合計スコア
VIEW1試験およびVIEW2試験において52週目のすべての投与群で、4.5~6.7ポイントのNEI VFQ-25合計スコアの変化が認められました。
ベースライン値からのNEI VFQ-25合計スコアの変化量(LOCF、FAS)

※ VIEW2試験において、92週目に再投与が行われた患者では、100週目の結果を最終評価として用いた
形態学的評価
(1)CNV病変面積
ベースライン値からのCNV病変面積の変化量(LOCF、FAS)
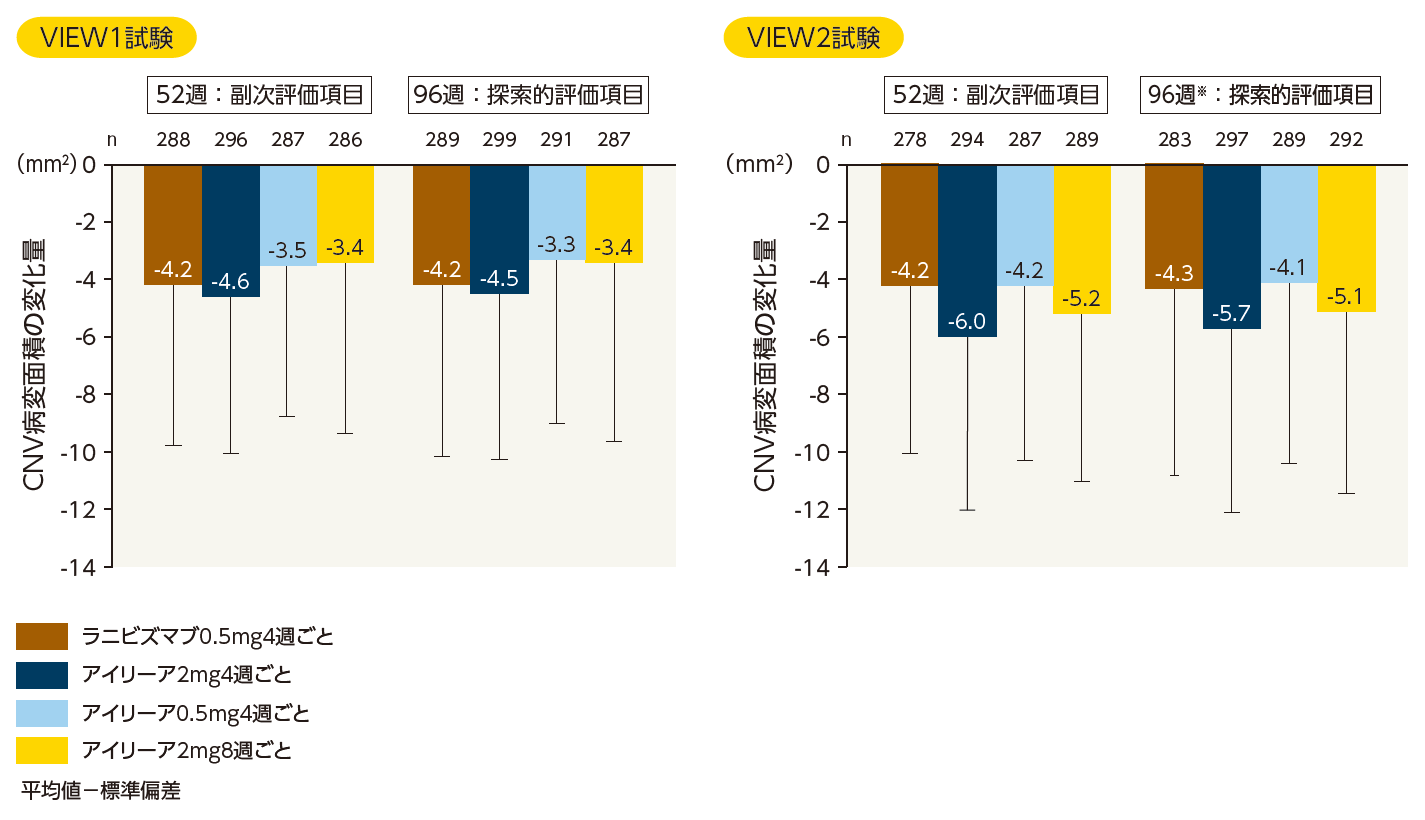
※ VIEW2試験において、92週目に再投与が行われた患者では、100週目の結果を最終評価として用いた
(2)中心網膜厚(CRT)
ベースライン値からのCRTの変化量(LOCF、FAS)

※ VIEW2試験において、92週目に再投与が行われた患者では、100週目の結果を最終評価として用いた
安全性(2年間の有害事象発現率)
国内外で実施された第Ⅲ相試験[2試験の併合解析(2年間)]において、副作用*1は、アイリーア投与群で1,824例中896例(49.1%)、ラニビズマブ投与群で595例中311例(52.3%)に認められました。主な副作用は、アイリーア投与群で結膜出血480例(26.3%)、眼痛158例(8.7%)、眼圧上昇89例(4.9%)、ラニビズマブ投与群で結膜出血171例(28.7%)、眼痛54例(9.1%)、眼圧上昇39例(6.6%)などでした。
VIEW1試験において、試験薬に関連する重篤な有害事象は、アイリーア投与群で白内障、脳血管発作が各1例、ラニビズマブ投与群で視力低下、偽眼内炎が各1例に認められ、試験薬に関連する投与中止に至った有害事象は、ラニビズマブ投与群で偽眼内炎が1例に認められました。なお、試験薬に関連する死亡は認められませんでした。
VIEW2試験において、試験薬に関連する重篤な有害事象は、アイリーア投与群で脳血管発作が3例、網膜出血、視力低下、網膜色素上皮裂孔、白内障、一過性脳虚血発作、急性冠動脈症候群、ラクナ梗塞、心筋梗塞、虚血性脳卒中、腎不全が各1例に認められ、ラニビズマブ投与群で網膜色素上皮裂孔が1例に認められました。試験薬に関連する投与中止に至った有害事象は、アイリーア投与群で脳血管発作*23例、黄斑変性、視力低下、網膜出血、薬疹、急性冠動脈症候群、ラクナ梗塞、虚血性脳卒中、腎不全、歩行障害*2、会話障害*2が各1例に認められました。なお、試験薬に関連する死亡は、アイリーア投与群で脳血管発作と虚血性脳卒中が各1例に認められました。
- *1
- 投与手技に起因する有害事象を含む。電子添文に準じ、併合での集計結果を記載した。
- *2
- 脳血管発作の1例と歩行障害および会話障害は同一症例
VIEW1試験※

発現例数(発現率%)
VIEW2試験※

発現例数(発現率%)
併合解析

発現例数(発現率%)
- a)
- アイリーア2mg4週ごと、0.5mg4週ごと、2mg8週ごと投与群の3群合算により検討
- b)
- すべての有害事象のうち、APTC(Antiplatelet Trialists' Collaboration)定義により判定された動脈血栓塞栓事象



