DME治療におけるアフリベルセプトの国内外の使用実績
糖尿病(耐糖能異常)とATE
ATE(arterial thromboembolism event):動脈血栓塞栓事象
糖尿病(耐糖能異常)はATEのリスク因子です
ATEのリスク因子
脳卒中発症に起因するリスク因子1)
高齢・高血圧症・男性・脂質異常症・糖尿病・心房細動・喫煙・大量飲酒
虚血性心疾患(狭心症、心筋梗塞など)のリスク因子2)
年齢・家族歴・喫煙・脂質異常症・高血圧・ストレス・耐糖能異常・肥満・メタボリックシンドローム・慢性腎臓病 (CKD)
久山町研究において、耐糖能レベルの悪化によりATE発症率が上昇したと報告されています
リスク:糖尿病(耐糖能異常)
久山町研究における耐糖能別の脳心血管イベント発症率3)
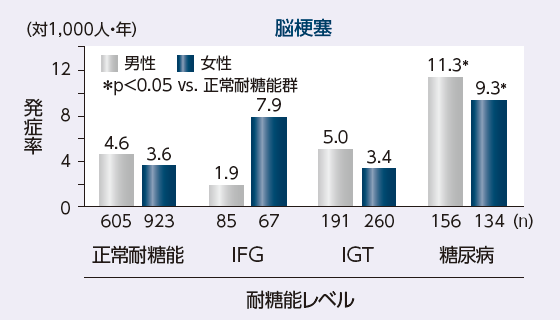
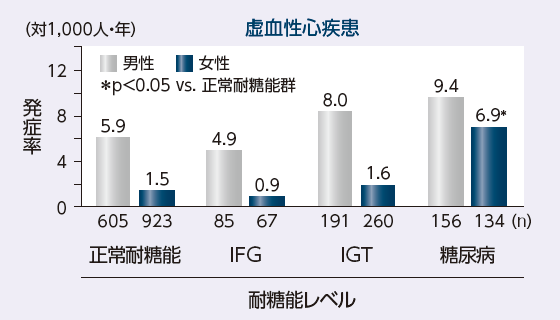
IFG : impaired fasting glycemia
IGT : impaired glucose tolerance
久山町第3集団2,421人、40~79歳、1988~2002年、年齢調整(Doi Y, et al.: Stroke. 2010; 41: 203-209. より引用改変)
1)日本脳卒中学会 脳卒中ガイドライン委員会: 脳卒中治療ガイドライン2021.
2)日本循環器学会 2011年度合同研究班: 虚血性心疾患の一次予防ガイドライン(2012年改訂版).
3)向井直子, 他: 福岡医誌. 2011; 102: 175-184.
米国でのコホート研究(NOMAS)
糖尿病罹病期間と脳卒中発症リスクの関係性について報告されています(海外データ)
糖尿病の罹病期間に関連する虚血性脳卒中の発症リスク4)
● 1年ごとに虚血性脳卒中の発症リスクが3%上昇

ハザード比と95%信頼区間にはCox比例ハザードモデルを用いた
* 年齢、性別、人種、教育、保険、胴囲、喫煙状況、アルコール消費量、身体活動、収縮期血圧、心臓病の病歴、LDLコレステロール、HDLコレステロールで調整した。
† 非糖尿病の参加者を対照とした。
対象:
前向き集団ベースのコホート研究であるThe Northern Manhattan Study (NOMAS) に参加した、脳卒中既往歴のない40歳以上の集団3,298例[登録時に糖尿病であった患者716例、非糖尿病であった参加者2,582例(うち、糖尿病を新規に発症した患者338例)]
方法:
糖尿病の発症は毎年評価した(中央値:9年)。虚血性脳卒中の発症率は、ベースライン時の糖尿病の有無、時間依存共変量としての糖尿病の有無、時間変化共変量としての糖尿病の罹病期間を主要な予測因子とし、Cox比例ハザードモデルを用いてハザード比と95%信頼区間を推定した。モデルは人口統計学的要因、行動的および医学的リスク因子で調整した。
4)Banerjee C, et al.: Stroke. 2012; 43: 1212‒1217.
DRCR.net Protocol T試験(海外データ)
5)The Diabetic Retinopathy Clinical Research Network: N Engl J Me d. 2015; 372: 1193-1203.
6)Wells JA, et al.: Ophthalmology. 2016; 123: 1351‒1359.
注意:本試験のラニビズマブの用量は0.3mgですが、日本でのラニビズマブの糖尿病黄斑浮腫への適応は0.5mgです。ベバシズマブは糖尿病黄斑浮腫に対して試験実施国(米国)および日本で未承認であるためベバシズマブ群の結果を削除しています。
試験概要
目的
中心窩に及ぶ糖尿病黄斑浮腫(DME)を有する患者を対象に、(1)アフリベルセプト硝子体内投与、(2)ベバシズマブ硝子体内投与、(3)ラニビズマブ硝子体内投与の有効性および安全性を比較検討すること
実施国/施設数
米国/89施設
試験デザイン
多施設共同無作為化比較試験
試験対象
中心窩に及ぶDMEを有する患者660例660眼※1
選択基準(抜粋)
[試験対象者]
- 18歳以上
- 1型あるいは2型糖尿病と診断されている
[試験対象眼]
- 最高矯正視力文字数(E-ETDRS)が78~24(近似スネレン等価視力20/32~20/320)
- 中心窩に及ぶDMEによる明らかな網膜肥厚を認める
- OCTによる中心サブフィールド網膜厚(CST)が250μm以上※2
主要評価項目
1年目における最高矯正視力文字数のベースラインからの変化量(ベースラインの最高矯正視力で調整)
副次評価項目
1年目における試験実施計画書に従った硝子体内投与回数 など
その他の評価項目
2年目における試験実施計画書に従った硝子体内投与回数 など
安全性の主な評価項目
投与手技に関連する※3、薬剤に関連する(眼※4、全身性※5)有害事象 など
解析計画
- 主要評価項目については、ベースライン視力を調整した共分散分析(ANCOVA)により群間比較を行う。その際、Hochberg法により多重性の調整を行う。欠測値については多重代入法を用いて補完する。平均値から3SD以上の外れ値は除外する。
- 副次評価項目については、評価項目に応じ、ベースライン因子を調整したANCOVAなど適切な手法を用いて検討する。
- 安全性評価項目については、片眼のみ、あるいは両眼とも投与を受けた患者群ごとの全身性有害事象の発現状況についても検討する。
- 事前に規定した解析として、主要評価項目および副次評価項目(1年目におけるCSTのベースラインからの変化量)について、ベースライン視力(<20/40 vs. ≧20/40)による層別解析を行うとともに交互作用についても検討する。
- 2年目については1年目の統計解析手法を踏襲する。
利益相反
本試験で用いられた薬剤(アフリベルセプト)はRegeneron社より提供された。著者にRegeneron社、Bayer Health-Care社から経済的支援、謝礼を受領している者(文献5、6)、Regeneron社の株式所有者(文献6)が含まれる。
なお、本試験の資金提供組織はNational Institutes of Health(NIH)であり、プロトコルの作成、実施、データの管理についてはDRCR.netが主体である。
※1 試験対象眼は各患者片眼のみとする。
※2 機種/性別ごとに規定
1. <250μm : Zeiss Stratus
2. <320μm(男性)、<305μm(女性):Heidelberg Spectralis
3. <305μm(男性)、<290μm(女性):Zeiss Cirrus
※3 眼内炎、牽引性網膜剥離、裂孔原性網膜剥離、網膜裂孔、白内障、眼内出血、眼圧上昇
※4 炎症、牽引性網膜剥離、牽引性網膜剥離の悪化・黄斑部への進行
※5 高血圧、腎事象、胃・消化管事象、APTC定義に基づく動脈血栓塞栓事象
日本におけるアイリーアの糖尿病黄斑浮腫に対する用法及び用量:
アフリベルセプト(遺伝子組換え)として2mg(0.05mL)を1ヵ月ごとに1回、連続5回硝子体内投与する。その後は、通常、2ヵ月ごとに1回、硝子体内投与する。なお、症状により投与間隔を適宜調節するが、1ヵ月以上あけること。
日本におけるラニビズマブの糖尿病黄斑浮腫に対する用法及び用量:
ラニビズマブ(遺伝子組換え)として1回あたり0.5mg(0.05mL)を硝子体内投与する。投与間隔は、1ヵ月以上あけること。日本におけるベバシズマブの糖尿病黄斑浮腫への適応は未承認です。
来院スケジュールと投与方法
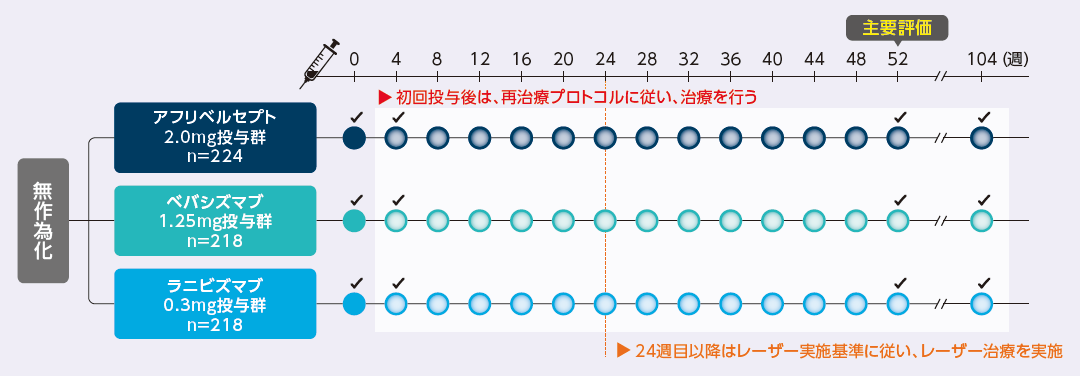
✔︎:血漿サンプル採取、血圧測定、尿サンプル採取(尿サンプルは104週目を除く)
52週目までは4週ごと来院
52週目以降は4週ごと来院を基本に、疾患状態および治療内容に従って、8週ごと、16週ごと来院に延長可能
52週目および104週目は全患者来院
抗VEGF薬再投与基準(4週目以降)
試験眼が以下のいずれかを満たす場合は、硝子体内投与を行う
- 前回または前々回の投与以降、OCTによる中心サブフィールド網膜厚(CST)または最高矯正視力の改善1)あるいは悪化2)が認められる
- 24週目まで:CSTが250μm3)以上、または最高矯正視力が20/20未満
一旦投与が延期された後、以下の場合は、硝子体内投与を再開する
- 前回の来院または投与以降、CSTまたは最高矯正視力の悪化2)が認められる
1)CSTが10%以上減少または最高矯正視力が5文字以上改善
2)CSTが10%以上増加または最高矯正視力が5文字以上悪化
3)機種/性別ごとに規定
1. <250μm : Zeiss Stratus
2. <320μm(男性)、<305μm(女性):Heidelberg Spectralis
3. <305μm(男性)、<290μm(女性):Zeiss Cirrus
アフリベルセプト投与群の糖尿病罹病期間(中央値)は15年でした
患者背景
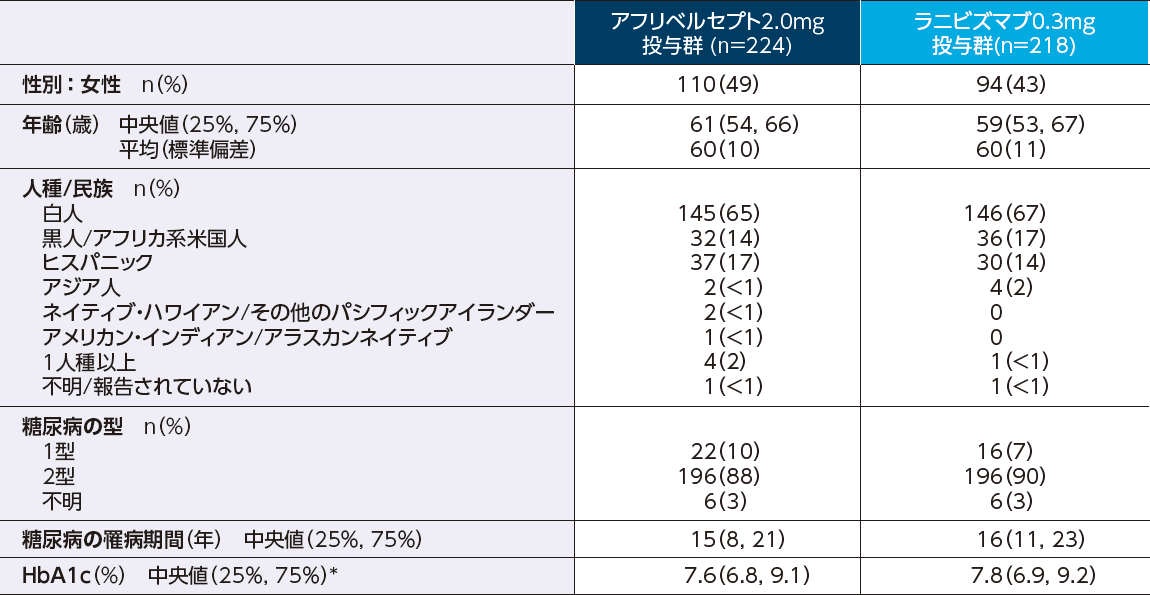
中央値(25%:第1四分位数、75%:第3四分位数)
*アフリベルセプト投与群に5例、ラニビズマブ投与群に1例のデータ欠測例あり。
The Diabetic Retinopathy Clinical Research Network: N Engl J Med. 2015; 372: 1193-1203. ※承認の範囲内の症例群のみに限定し、一部改変 Copyright© 2015 Massachusetts Medical Society. All rights reserved. Translated with permission.
<52週:主要評価項目>
アフリベルセプト投与群におけるベースラインから52週後の最高矯正視力文字数の変化量は+13.3文字であり、ラニビズマブ投与群の+11.2文字に比べて有意差が認められました
※ベースライン視力と治療群との間に有意な交互作用が認められました。
最高矯正視力文字数のベースラインからの変化量の推移
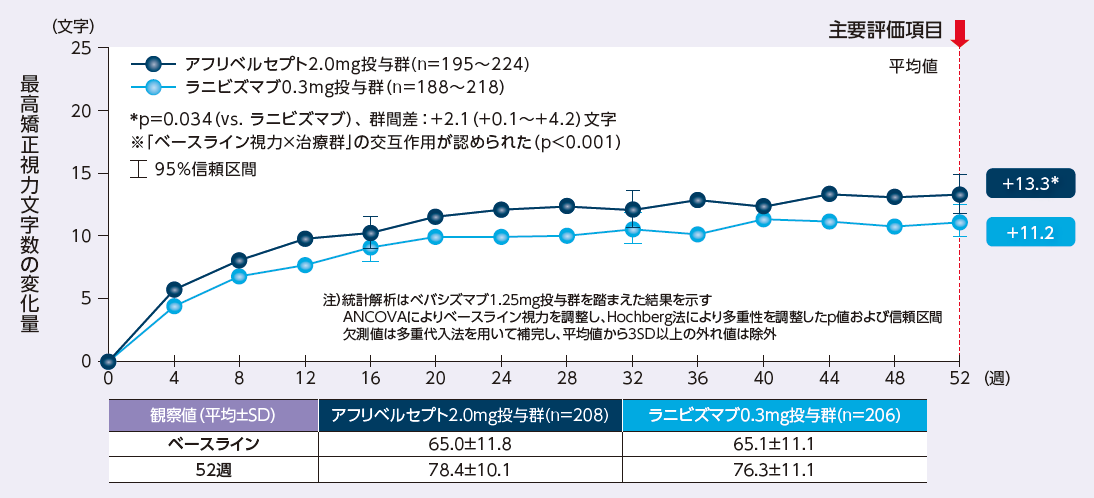
The Diabetic Retinopathy Clinical Research Network: N Engl J Med. 2015; 372: 1193-1203. ※承認の範囲内の症例群のみに限定し、一部改変
Copyright© 2015 Massachusetts Medical Society. All rights reserved. Translated with permission.
ベースライン視力≦20/50の患者集団では、アフリベルセプト投与群における52週後の最高矯正視力文字数の変化量は+18.9文字であり、ラニビズマブ投与群の+14.2文字に比べて有意差が認められました
最高矯正視力文字数のベースラインからの変化量の推移(層別解析:ベースライン視力別)
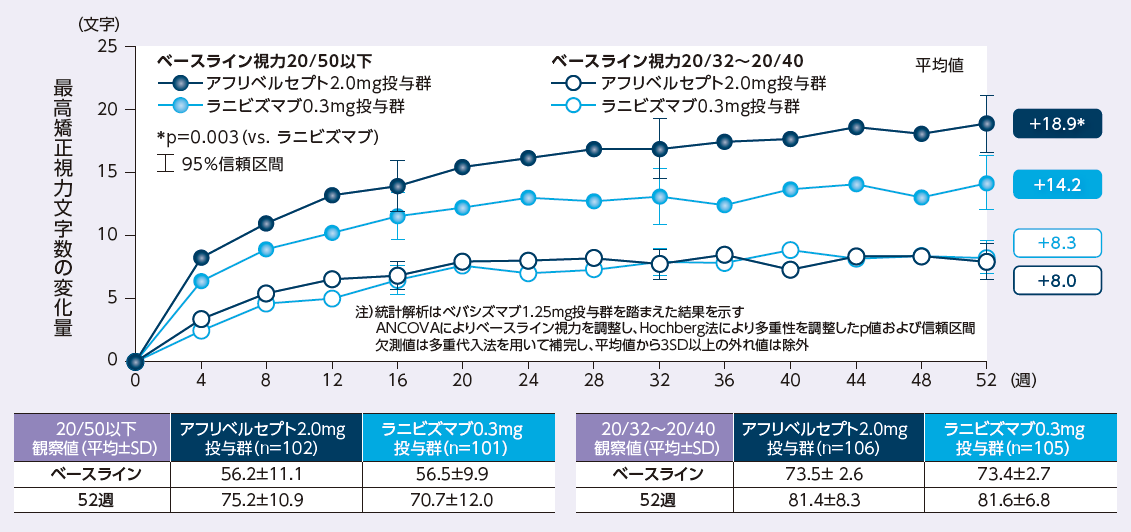
The Diabetic Retinopathy Clinical Research Network: N Engl J Med. 2015; 372: 1193-1203. ※承認の範囲内の症例群のみに限定し、一部改変
Copyright© 2015 Massachusetts Medical Society. All rights reserved. Translated with permission.
<1年目:副次評価項目、2年目:その他の評価項目>
アフリベルセプト投与群におけるアフリベルセプトの投与回数は、1年目が9回、2年目が5回、2年間の累積で15回でした
抗VEGF薬による治療回数
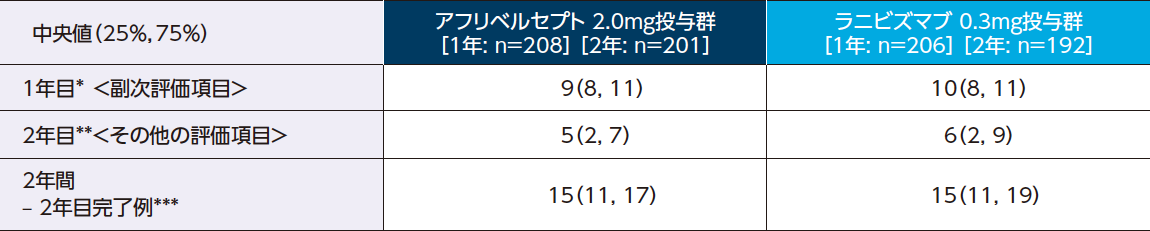
中央値(25%:第1四分位数、75%:第3四分位数)
全体比較(Kruskal-Wallis Test)においてp<0.05の場合に、多重性を調整した(全体比較と対比較のうちp値が大きい方を採用)対比較(Wilcoxon Rank Sum Test)を行った。
* 全体比較:p=0.045、対比較:アフリベルセプト vs. ラニビズマブ:p=0.19
** 全体比較:p=0.32
*** 全体比較:p=0.08
※全体比較のp値はベバシズマブ1.25mg投与群を含めて解析した結果を示す。
The Diabetic Retinopathy Clinical Research Network: N Engl J Med. 2015; 372: 1193-1203.より作表
Wells JA, et al.: Ophthalmology. 2016; 123: 1351-1359. ※承認の範囲内の症例群のみに限定し、一部改変
アフリベルセプト投与群における試験眼に発現した眼の主な有害事象は、霧視24.1%、硝子体浮遊物18.3%、結膜出血15.2%などが認められました
試験眼に発現した眼の主な有害事象†(2年間)
- アフリベルセプト投与群224例中、霧視54例(24.1%)、硝子体浮遊物41例(18.3%)、結膜出血34例(15.2%)、白内障28例(12.5%)、眼痛25例(11.2%)、視力低下22例(9.8%)、眼乾燥20例(8.9%)、嚢下白内障17例(7.6%)、眼刺激16例(7.1%)、流涙増加および硝子体出血各15例(6.7%)、視力障害12例(5.4%)であった。
- ラニビズマブ投与群218例中、霧視50例(22.9%)、硝子体浮遊物49例(22.5%)、結膜出血26例(11.9%)、眼痛23例(10.6%)、視力低下22例(10.1%)、眼乾燥20例(9.2%)、眼そう痒症16例(7.3%)、眼刺激15例(6.9%)、白内障13例(6.0%)、流涙増加および眼充血各11例(5.0%)であった。
全身性の主な有害事象†(2年間)
- アフリベルセプト投与群224例中、高血圧39例(17.4%)、鼻咽頭炎39例(17.4%)、咳嗽22例(9.8%)、貧血、頭痛および副鼻腔炎各20例(8.9%)、嘔吐および尿路感染各17例(7.6%)、インフルエンザ16例(7.1%)、コントロール不良の糖尿病、高コレステロール血症、上気道感染各15例(6.7%)、胃食道逆流性疾患、季節性アレルギーおよび慢性腎不全各14例(6.3%)、低血糖、背部痛および浮動性めまい各13例(5.8%)、悪心、転倒、腎不全、気管支炎および蜂巣炎各12例(5.4%)であった。
- ラニビズマブ投与群218例中、高血圧44例(20.2%)、鼻咽頭炎29例(13.3%)、インフルエンザおよび頭痛各20例(9.2%)、上気道感染19例(8.7%)、肺炎および副鼻腔炎各18例(8.3%)、背部痛17例(7.8%)、貧血15例(6.9%)、コントロール不良の糖尿病、浮動性めまいおよび咳嗽各14例(6.4%)、下痢、ウイルス性胃腸炎および悪心各13例(6.0%)、うっ血性心不全、ビタミンD欠乏、腎不全、尿路感染および蜂巣炎各12例(5.5%)、低血糖、末梢性浮腫、季節性アレルギー、転倒、脱水、関節痛および気管支炎各11例(5.0%)であった。
※ ICH国際医療用語集(MedDRA)のコード化を用いたメディカルモニターに基づく事象
† 発現率5.0%以上とする。
Wells JA, et al.: Ophthalmology. 2016; 123: 1351-1359. ※承認の範囲内の症例群のみに限定し、一部改変
アフリベルセプト投与群のAPTC定義に基づく動脈血栓塞栓事象の発現率は5%でした
事前に規定した注目すべき全身性の有害事象(2年間)
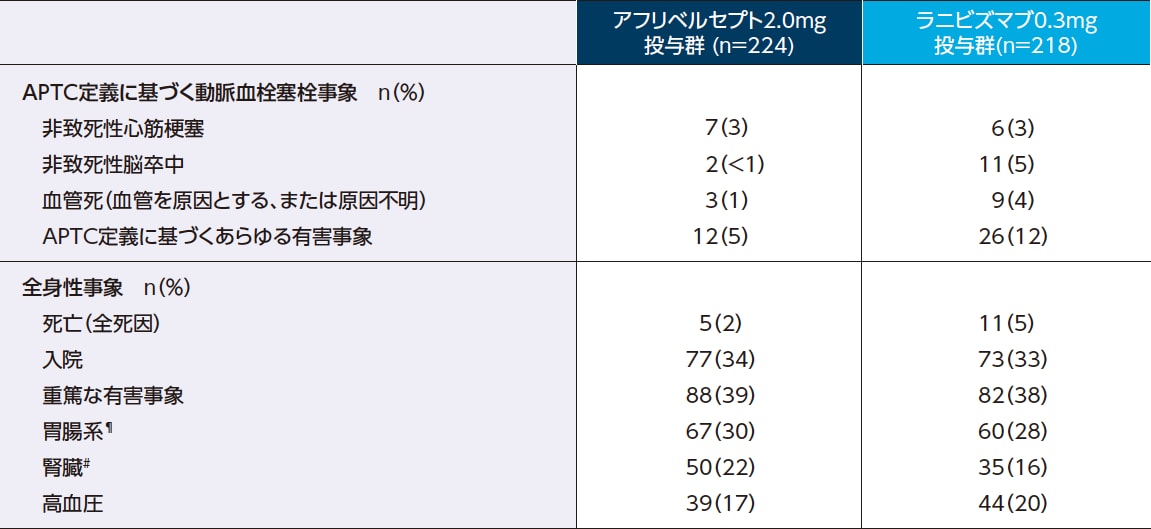
¶ ICH 国際医薬用語集(MedDRA)の器官別大分類の胃腸障害の事象を含む。
# MedDRAの器官別大分類の内因性腎障害を示す腎および尿路障害事象のサブセットに加えて、他の器官別大分類の血中クレアチニン上昇もしくは異常または腎移植を含む。
Wells JA, et al.: Ophthalmology. 2016; 123: 1351-1359. ※承認の範囲内の症例群のみに限定し、一部改変
心筋梗塞・脳卒中の既往歴のある患者における抗VEGF薬の投与はATE発現リスクが高まる可能性があるため注意が必要です
9. 特定の背景を有する患者に関する注意(一部抜粋)
- 9.1
- 合併症・既往歴等のある患者
- 9.1.2
- 脳卒中又は一過性脳虚血発作の既往歴等の脳卒中の危険因子のある患者[ 11.1.2、15.1.1 参照]
11. 副作用(一部抜粋)
- 11.1
- 重大な副作用
- 11.1.2
- 脳卒中(0.2%)[9.1.2、15.1.1 参照]
15. その他の注意(一部抜粋)
- 15.1
- 臨床使用に基づく情報
- 15.1.1
- 本剤投与により、全身のVEGF阻害に起因する動脈血栓塞栓に関連する有害事象(心筋梗塞、脳卒中、血管死等)が発現する可能性がある。滲出型加齢黄斑変性患者を対象に国内外で実施された第Ⅲ相試験[2試験の併合解析(2年間)]における動脈血栓塞栓関連事象の発現率は、本剤投与群全体で3.3%(1824例中60例)であった。網膜中心静脈閉塞症に伴う黄斑浮腫を有する患者を対象に国内外で実施された第Ⅲ相試験[2試験(76週間と100週間)の併合解析]における動脈血栓塞栓関連事象の発現率は、本剤投与群全体で0.6%(317例中2例)であった。網膜静脈分枝閉塞症に伴う黄斑浮腫を有する患者を対象に国内外で実施された第Ⅲ相試験[1試験(52週間)]における動脈血栓塞栓関連事象の発現率は、本剤投与群全体で0.6%(158例中1例)であった。病的近視における脈絡膜新生血管患者を対象に国内外で実施された第Ⅲ相試験[1試験(48週間)]における動脈血栓塞栓関連事象の発現率は、本剤投与群全体で0.9%(116例中1例)であった。糖尿病黄斑浮腫を有する患者を対象に国内外で実施された第Ⅲ相試験[3試験(1年間)の併合解析]における動脈血栓塞栓関連事象の発現率は、本剤投与群全体で2.9%(730例中21例)であった。血管新生緑内障患者を対象に国内で実施された第Ⅲ相試験[2試験(13週間と5週間)]における動脈血栓塞栓関連事象の発現率は、本剤投与群全体で1.5%(66例中1例)であった。[9.1.2、11.1.2 参照]
アイリーア®硝子体内注射用キット40mg/mL 電子添文 2022年9月改訂(第2版、再審査結果)より抜粋
再審査結果のお知らせ(2022年9月7日付け)
再審査対象適応症

アイリーアの適応症のうち、「中心窩下脈絡膜新生血管を伴う加齢黄斑変性」、「病的近視における脈絡膜新生血管」、「糖尿病黄斑浮腫」、「網膜静脈閉塞症に伴う黄斑浮腫」につきまして、「再審査結果」の通知がありましたのでご案内申し上げます。
再審査における有効性・安全性の評価において、現時点で変更すべき問題はなく、「効能又は効果」および「用法及び用量」に変更はございません。
製造販売後調査等の結果および再審査結果の詳細につきましては、PMDAホームページに掲載されております「再審査報告書」よりご確認いただくことができます。
本剤の調査にご協力賜りましたことに重ねて御礼申し上げますとともに、今後ともご愛顧を賜りますよう、お願い申し上げます。
アイリーアは2012年に発売されて以来、臨床試験や使用成績調査など
豊富なエビデンス、国内使用実績を持つ薬剤です



