nAMD治療のトレンド「T&E」を用いたアイリーアのQ4 to Q16
アイリーア(2mg)の承認された効能又は効果(抜粋):中心窩下脈絡膜新生血管を伴う加齢黄斑変性
本ページでは、「アイリーア(2mg)」を「アイリーア」と記載しています。
個別化治療のなかでも、T&Eは患者ごとに合わせた適切な投与間隔を調節する「プロアクティブな」投与方法です
nAMDにおける抗VEGF薬の投与方法

監修:多根記念眼科病院 病院長 大路 正人 先生
アンケート調査に回答した日本のnAMD専門医の約半数が、維持期の投与方法にT&Eを選択していました
新生血管型加齢黄斑変性診療の実態:実地診療を担う専門医を対象としたアンケート調査
nAMD治療の維持期の治療方針(抗VEGF薬投与レジメン)

- ※
- T&E変法(modified T&E)を含む
対象:
nAMD専門医であり、2018年11月にバイエル薬品の主催により東京で開催されたwAMD Real Practice Discussion会議に参加した84名の医師(開業医16名、基幹・市中病院の医師21名、大学病院の医師47名)
方法:
当日の会議において、参加した医師の背景、nAMDの診断および治療に関するアンケート調査を行った。回答は断りがない限り単一回答とし、医師はAnswer Padを用いて回答の選択肢の中から該当する回答を選択した。質問ごとに各回答の選択肢を選んだ医師の数(回答数)と割合(当該質問に回答した医師の総数を母数とした)を求めた。
利益相反:
本論文の作成に際し、バイエル薬品から資金提供を受け、インターサイエンス社が執筆および投稿の支援を行った。本論文に使用したデータは、バイエル薬品が主催した会議のなかで実施されたアンケート調査で得られたものである。ただし、バイエル薬品はアンケート調査で得られたデータの集計、解釈、本論文の記載方針や内容については一切関与しなかった。
髙橋 寛二 ほか: 眼科 2020; 62: 494-502.
滲出型加齢黄斑変性患者におけるTreat and Extendレジメンによるアイリーア硝子体内投与の有効性と安全性:
ALTAIR試験の52および96週間の結果
Ohji M, et al.: Adv Ther. 2020; 37: 1173‒1187.
試験概要
目的
nAMD患者において、アイリーア硝子体内投与の間隔を最短8週および最長16週として、2つの投与間隔の調節方法(2週幅調節と4週幅調節)における有効性および安全性を検討する。
試験デザイン
96週、無作為化、多施設共同(国内41施設)、オープンラベル、第Ⅳ相臨床試験
試験対象
50歳以上で、活動性の中心窩下脈絡膜新生血管(CNV)病変を伴う未治療nAMD患者
(ETDRS視力表による最高矯正視力文字数が73~25文字、スネレン視力20/40~20/320相当)
投与方法
導入期投与としてアイリーア(アフリベルセプトとして2mg)を3回連続毎月投与後、16週時にT&Eレジメンに基づき、アイリーア2週幅調節群と4週幅調節群に1:1になるよう無作為に割り付けた。4週幅調節群における4週短縮後は、2週間隔で調節した。
評価例数
安全性解析対象集団(SAS):254例( 2週幅調節群:124例、4週幅調節群:123例、無作為化割付前脱落:7例)
最大の解析対象集団(FAS):246例( 2週幅調節群:123例、4週幅調節群:123例)
主な評価項目
<主要評価項目>
52週時における最高矯正視力文字数のベースラインからの変化量
<副次評価項目>
52週時における15文字以上視力が改善した患者の割合、52週時における視力を維持した患者の割合(15文字未満の視力低下)、52週時における中心網膜厚(CRT)のベースラインからの変化量 など
<その他の評価項目>
96週時における上記の項目、96週時までの最高矯正視力文字数の推移、96週時までのCRTの推移、IRF/SRFを有する患者の割合
<投与に関する評価項目>
平均投与回数、平均投与間隔、最終投与時の投与間隔 など
<安全性評価項目>
治療下で発現した有害事象(TEAE)、すべての有害事象、APTC定義に基づく動脈血栓塞栓事象(ATE) など
<事前に規定された評価項目(サブグループ解析)>
- 16週時点における滲出の有無別にみた有効性評価項目(52週時および96週時における最高矯正視力文字数のベースラインからの変化量、52週時および96週時におけるCRTのベースラインからの変化量、平均投与回数、最終投与時の投与間隔 など)
- PCVサブグループにおける有効性評価項目(52週時および96週時における最高矯正視力文字数のベースラインからの変化量、96週時における視力を維持した患者の割合、52週時および96週時におけるCRTのベースラインからの変化量、96週時までの最高矯正視力文字数の推移、96週時までのCRTの推移、平均投与回数、最終投与時の投与間隔 など)
解析計画
探索的な解析
- 主要評価項目、副次評価項目、その他の評価項目、投与に関する評価項目、サブグループ解析:FAS
- 安全性評価項目:SAS
すべての統計解析は探索的であり、検証的な解析は行わなかった。記述的に統計学的な比較を可能とする例数設計に基づき、両群が達成したアウトカムを記述した。なお、欠測値はLOCF法によって補完した。
利益相反
本研究はバイエル薬品の資金によって実施され、同社は試験デザイン作成、試験実施、データ収集、データ管理、データ解析、ならびに原稿作成などに関与した。
著者のうち3名は、バイエルヘルスケアAG、バイエル薬品、あるいは参天製薬からコンサルタント料や研究助成金などを受領している。また、著者のうち3名は、バイエル薬品の社員である。
事後サブグループ解析
PCVサブグループにおける上記すべての安全性評価項目† など
- 主要評価項目、副次評価項目、その他の評価項目、投与に関する評価項目、サブグループ解析:FAS
- 安全性評価項目:SAS
- †
- PCVサブグループにおける安全性に関する情報提供のため、全集団の解析結果に含まれる内容ではありますが、本事後サブグループ解析 結果を掲載しています。
ETDRS:early treatment diabetic retinopathy study
SAS(safety analysis set):無作為化割付前に1回以上試験薬の投与を受けたすべての患者
FAS(full analysis set):無作為化割付後に1回以上試験薬の投与を受け、ベースラインと無作為化割付後に1回以上の最高矯正視力の評価を受けたすべての患者
TEAE(treatment-emergent adverse event):初回投与から最終投与後30日以内に生じた有害事象
LOCF(last observation carried forward):最終評価スコア外挿法
PCV(polypoidal choroidal vasculopathy):ポリープ状脈絡膜血管症
投与スケジュール

- *
- 投与方法の決定は事前に規定された基準に従い、投与間隔を最短8週、最長16週とする。
- †
- 2週幅調節群では、アイリーア硝子体内投与を2週間隔で調節。4週幅調節群では、アイリーア硝子体内投与を4週間隔で調節。ただし、4週短縮後は、2週間隔で調節した。
Ohji M, et al.: Adv Ther. 2020; 37: 1173‒1187.(Supplementary material 2:Figure S1)
ALTAIR試験のT&Eレジメンの特徴
投与間隔の短縮/維持/延長基準

投与間隔の調節 2週幅調節/4週幅調節
最短および最長投与間隔 最短投与間隔:8週/最長投与間隔:16週
- *1
- 光干渉断層計(optical coherence tomography:OCT)による評価
- *2
- 中心窩を中心とした直径1mmのサブフィールド内
- *3
- 網膜内あるいは網膜下
- *4
- OCTスキャン領域全体
Ohji M, et al.: Adv Ther. 2020; 37: 1173‒1187. より作成
患者背景および疾患特性(FAS)

- *
- 重複あり
- †
- 2週幅調節群の2例、4週幅調節群の1例は分類不明、4週幅調節群の1例はCNVが認められなかった。
SD(standard deviation):標準偏差
RAP(retinal angiomatous proliferation):網膜内血管腫状増殖
FA(fluorescein angiography):フルオレセイン蛍光眼底造影
Ohji M, et al.: Adv Ther. 2020; 37: 1173‒1187.
中心窩下脈絡膜新生血管を伴う加齢黄斑変性に対するアイリーアの承認 6. 用法及び用量:「アフリベルセプト(遺伝子組換え)として2mg(0.05mL)を1ヵ月ごとに1回、連続3回(導入期)硝子体内投与する。その後の維持期においては、通常、2ヵ月ごとに1回、硝子体内投与する。なお、症状により投与間隔を適宜調節するが、1ヵ月以上あけること。」
アイリーアのT&E投与により、52週時において2週幅調節群で+9.0文字、4週幅調節群で+8.4文字でした
最高矯正視力文字数のベースラインからの変化量の推移
<52週:主要評価項目、96週:その他の評価項目>
(FAS)

96週までの投与回数、平均(SD)

各群の平均値(95%CI)は1標本t統計量、群間差は投与群とnAMDの病型を固定効果、ベースライン最高矯正視力文字数を共変量としたANCOVAモデルによって算出した。欠測値はLOCF法によって補完した。
CI(confidence interval):信頼区間
Ohji M, et al.: Adv Ther. 2020; 37: 1173‒1187.
2週・4週幅調節のT&Eを用いた96週までの最終投与間隔が16週であった患者割合はそれぞれ、41.5%、46.3%でした
96週までの最終投与間隔<投与に関する評価項目>
(FAS)

Ohji M, et al.: Adv Ther. 2020; 37: 1173‒1187.
すべての治療下で発現した有害事象(TEAE)は 、2週幅調節群で85例(68.5%)、4週幅調節群で86例(69.9%)に認められました
すべてのTEAE<安全性評価項目>
(SAS)

- *
- 無作為化割付前脱落の理由は「医師の判断」(n=1)、「通院困難」(n=1)、「試験実施計画書違反」(n=2)、「患者による同意の撤回」(n=3)
- †
- いずれかの群で確認された眼に関連するTEAE≧2%
- ‡
- いずれかの群で確認された全身性のTEAE≧3%
有害事象の報告にはMedDRA version 19.1が用いられた。
Ohji M, et al.: Adv Ther. 2020; 37: 1173‒1187.より抜粋
APTC定義に基づく動脈血栓塞栓事象(ATE)は、2週幅調節群で1例(0.8%)、4週幅調節群で2例(1.6%)に認められました
APTC定義に基づくATE<安全性評価項目>
(SAS)

試験薬に関連する重篤な有害事象:
白内障2例(2週幅調節群、4週幅調節群 各1例)、脳血管発作1例(4週幅調節群)
試験薬に関連する投与中止に至った有害事象:
蕁麻疹1例(4週幅調節群)
試験薬に関連する死亡:
本試験において試験薬に関連する死亡は報告されなかった
ALTAIR試験 社内資料
- *
- 無作為化割付前脱落の理由は「医師の判断」(n=1)、「通院困難」(n=1)、「試験実施計画書違反」(n=2)、「患者による同意の撤回」(n=3)
- §
- 2例で3件報告された。
有害事象の報告にはMedDRA version 19.1が用いられた。
Ohji M, et al.: Adv Ther. 2020; 37: 1173‒1187.より抜粋
ALTAIR試験におけるTreat and Extendレジメンによるアイリーア硝子体内投与の有効性と安全性:
PCVサブグループ解析による96週間の結果
Okada AA, et al.: Adv Ther. 2022; 39(6): 2984-2998.
利益相反:
本研究はバイエル薬品の資金によって実施され、同社は試験デザイン作成、試験実施、データ収集、データ管理、データ解析、ならびに原稿作成などに関与した。著者のうち3名は、バイエルヘルスケアAG、バイエル薬品、あるいは参天製薬からコンサルタント料や研究助成金などを受領している。また、著者のうち3名は、バイエル薬品の社員である。
患者背景および疾患特性(FAS)

BCVA(best-corrected visual acuity):最高矯正視力
PED(pigment epithelial detachment):色素上皮剥離
SRF(subretinal fluid):網膜下液
IRF(intraretinal fluid):網膜内液
a:nAMDの病型が不明
b:複数のnAMD病型が選択された患者が含まれる
アイリーアのT&E投与により、52週時において2週幅調節群で+7.5文字、4週幅調節群で+8.2文字でした
<PCVサブグループ解析>
最高矯正視力文字数のベースラインからの変化量の推移
(FAS)

96週までの投与回数、平均(SD)

Okada AA, et al.: Adv Ther. 2022; 39(6): 2984-2998.
2週・4週幅調節のT&Eを用いた96週までの最終投与間隔が16週であった患者割合はそれぞれ、41.3%、47.7%でした
<PCVサブグループ解析>
96週までの最終投与間隔
(FAS)

Okada AA, et al.: Adv Ther. 2022; 39(6): 2984-2998.
PCV集団において、すべてのTEAEは2週幅調節群で30例(65.2%)、4週幅調節群で37例(84.1%)に認められました
<PCVサブグループ解析:事後解析(96週)>
安全性(96週)<PCVサブグループ解析:事後解析>
(SAS)

SAE(serious adverse event):重篤な有害事象
APTC:Antiplatelet Trialists’ Collaboratio
試験薬に関連する重篤な有害事象:白内障1例(2週幅調節群)
試験薬に関連する投与中止に至った有害事象:蕁麻疹1例(4週幅調節群)
本試験において試験薬に関連する死亡は報告されなかった
(バイエル薬品 社内資料)
- *
- 無作為化割付前脱落の理由は「試験実施計画書違反」(n=1)、「患者による同意撤回」(n=1)
- †
- 試験眼における眼のSAE以外に、不安定狭心症、顔面骨骨折、乳癌、頭蓋内出血、腎結石症、および僚眼における加齢黄斑変性(各1例)
- ‡
- 胆石症、蜂窩織炎、胃癌、喉頭癌、肺悪性腫瘍、リンパ腫、脊髄硬膜外血腫および僚眼における白内障(各1例)、7例で8件報告された。 有害事象の報告にはMedDRA version 19.1が用いられた。
Okada AA, et al.: Adv Ther. 2022; 39(6): 2984-2998.
Okada AA, et al.: Adv Ther. 2022; 39(6): 2984-2998.
アイリーアのTreat and Extendレジメンによる長期視力成績と投与間隔(4年データ)
Ishibashi K, et al.: Ther Adv Ophthalmol. 2021; 13: 1-5.
試験概要
目的
nAMD患者に対する、T&Eレジメンを用いたアイリーア硝子体内投与の、4年間の有効性および解剖学的転帰を評価する。
試験デザイン
単一施設、カルテレビュー、レトロスペクティブ研究
試験対象
2013年2月から2018年9月までに久留米大学病院を受診したnAMD患者のカルテをレトロスペクティブにレビューし、T&Eレジメンによって少なくとも4年間継続してアイリーアを硝子体内投与した39例39眼(男性25例、女性14例)を対象とした。全患者において片眼を試験対象眼とした。
投与方法
対象患者は、網膜内液および網膜下液が認められない状態に改善するまで、アイリーア(アフリベルセプトとして2mg)を少なくとも3回毎月投与した。
その後、滲出性変化※に基づいて2週幅で調整するT&Eレジメンが行われた。滲出性変化が認められた場合は投与間隔を2週間短縮し、滲出性変化が認められなかった場合は投与間隔を2週間延長した(最短投与間隔:4週、最長投与間隔:20週)。
※
滲出性変化の定義:SD-OCTにより検出される新規の網膜出血または網膜内液および/または網膜下液
評価項目
ETDRS視力表による最高矯正視力文字数とSD-OCTによる中心窩黄斑厚(CMT)のベースラインからの変化
解析計画
BCVAおよびCMTのベースラインとの比較には、Wilcoxon符号付順位和検定を用いた。
利益相反
著者にバイエル薬品より謝礼および研究費を受領している者が含まれる。
SD:spectral domain
CMT:central macular thickness
安全性の情報は以下の通りでした
安全性
論文中に安全性に関する記載はありませんでした。
(安全性情報はDIをご参照ください。)
アイリーアのT&E投与により、最高矯正視力文字数はベースラインと比較して1、2、3、4年目において有意に増加しました
最高矯正視力文字数のベースラインからの推移
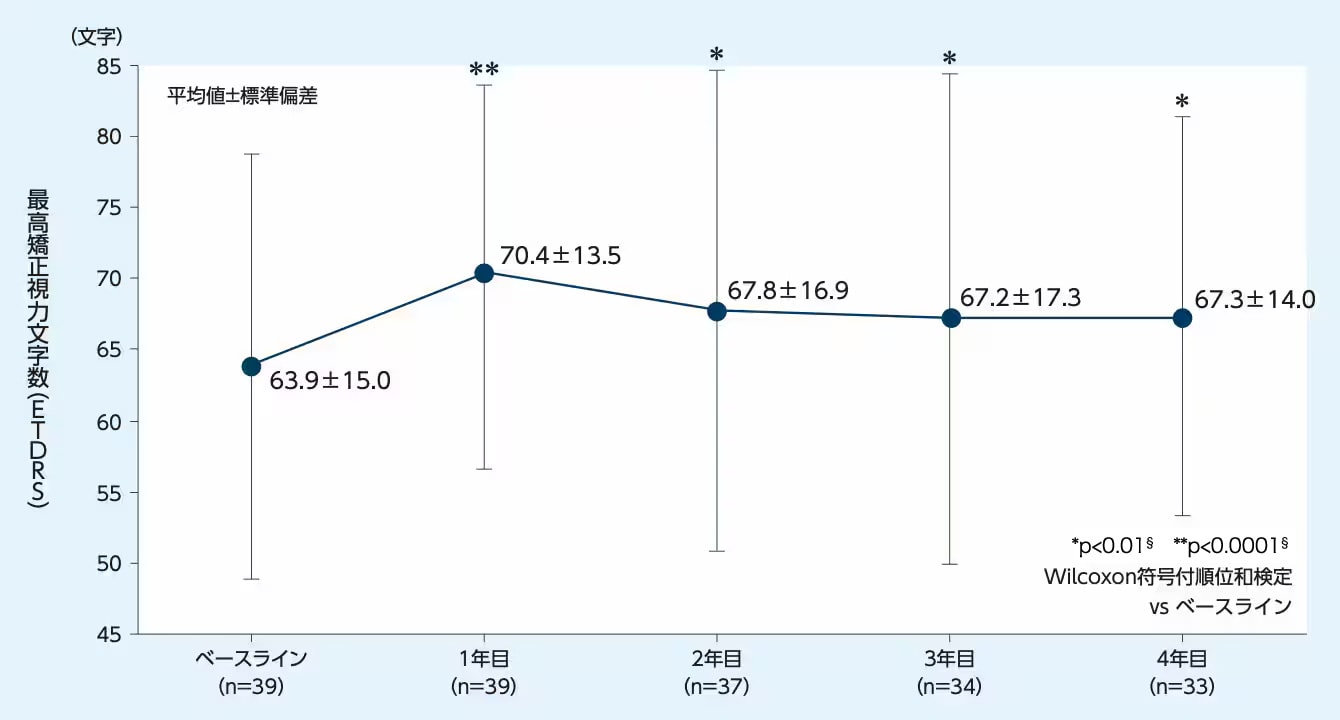
治療期間中に試験眼で白内障手術を受けた患者は、術後の最高矯正視力の分析から除外した。
§ 名目上のp値
Ishibashi K, et al.: Ther Adv Ophthalmol. 2021; 13: 1-5.
4年目の投与間隔が12週以上であった患者の割合は46.2%でした
投与間隔分布

Ishibashi K, et al.: Ther Adv Ophthalmol. 2021; 13: 1-5.
まとめ
アイリーアは維持期においてQ4からQ16の投与調節が可能であり、疾患活動性やアドヒアランスの状態など、個々の患者背景に合わせた積極的な個別化治療が可能な薬剤です
nAMDでは各患者に合った「個別化治療」が必要と考えられますが、アンケート調査に回答した日本のnAMD専門医の約半数が、維持期の投与方法にT&Eを選択していました1)。
ALTAIR試験2, 3)
アイリーアのT&E投与により、52週時において2週幅調節群で+9.0文字、4週幅調節群で+8.4文字でした。
96週までの最終投与間隔が16週であった患者割合は、2週幅調節群で41.5%、4週幅調節群で46.3%、 PCVサブグループ解析では、2週幅調節群で41.3%、4週幅調節群で47.7%でした。
試験薬に関連する重篤な有害事象は、白内障2例、脳血管発作1例、試験薬に関連する投与中止に至った有害事象は蕁麻疹1例が認められ、試験薬に関連する死亡は報告されませんでした。
Ishibashi K, et al.: Ther Adv Ophthalmol. 20214)
アイリーアのT&Eを用いた4年間の国内成績が報告されており、最高矯正視力文字数はベースラインと比較して1、2、3、4年目において有意に増加しました。
4年目の投与間隔が12週以上であった患者の割合は46.2%でした。
論文中に安全性に関する記載はありませんでした。(安全性情報はDIをご参照ください。)
アイリーアは2012年に日本で発売されて以来、臨床試験や使用成績調査など豊富なエビデンス、国内使用実績をもつ薬剤です。
- 1)
- 髙橋 寛二 ほか: 眼科 2020; 62: 494-502.
- 2)
- Ohji M, et al.: Adv Ther. 2020; 37: 1173 -1187.
- 3)
- Okada AA, et al.: Adv Ther. 2022; 39(6): 2984-2998.
- 4)
- Ishibashi K, et al.: Ther Adv Ophthalmol. 2021; 13: 1-5.



