nAMD治療におけるアフリベルセプト(2mg)の国内外の使用実績
高齢者とATE
ATE(arterial thromboembolism event):動脈血栓塞栓事象
高齢はATEのリスク因子です
ATEのリスク因子
脳卒中発症に起因する主なリスク因子1)
高齢・高血圧症・男性・脂質異常症・糖尿病・心房細動・喫煙・大量飲酒
冠動脈疾患(急性心筋梗塞など)の主なリスク因子2)
高血圧、脂質異常、糖尿病・肥満、喫煙、高齢者、女性、家族性高コレステロール血症、慢性腎臓病(CKD)、小児
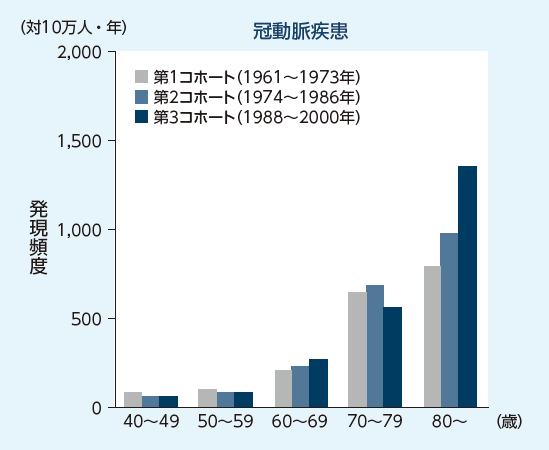
久山町研究において加齢によりATE発症率が上昇したと報告されています
リスク:高齢
久山町研究における年齢群別の脳梗塞、脳出血、くも膜下出血および冠動脈疾患の発現頻度(10万人・年あたりの発現例数)3)



1)日本脳卒中学会 脳卒中ガイドライン委員会: 脳卒中治療ガイドライン2021[改訂2023].
2)日本循環器学会 2021-2022年度活動 合同研究班: 2023年改訂版 冠動脈疾患の一次予防に関する診療ガイドライン.
3)Kubo M, et al.: Stroke. 2003; 34: 2349-2354.
アイリーア(2mg)の特定使用成績調査(PMS)
アイリーア(2mg)投与患者には高齢者が含まれており、市販後に長期安全性が検討されました(最長3年)
PMS対象患者の年齢分布(nAMD)4)
● 70%以上が70歳以上と高齢

<調査概要>
調査対象:
中心窩下脈絡膜新生血管を伴う加齢黄斑変性(nAMD)の治療のためにアイリーア(2mg)が投与される患者で、アイリーア(2mg)の使用経験のない患者
調査方法:
EDCを用いた中央登録方式
調査期間:
2012年12月~2018年12月
EDC:Electronic Data Capture
4)社内資料: アイリーアⓇ硝子体内注射液40mg/mL 特定使用成績調査(PMS)の最終報告 -中心窩下脈絡膜新生血管を伴う加齢黄斑変性(nAMD)-.
5)厚生労働省網膜脈絡膜・視神経萎縮症調査研究班加齢黄斑変性診断基準作成ワーキンググループ: 日眼会誌. 2008; 112: 1076-1084.
日本人を含む第Ⅲ相国際共同試験:
VIEW2試験6)(ラニビズマブに対する非劣性の検証)
6)バイエル薬品社内資料[日本人を含む第Ⅲ相国際共同試験: VIEW2試験]承認時評価資料

本剤は海外で実施された第Ⅰ相試験、第Ⅱ相試験の結果および海外第Ⅲ相試験、日本人を含む第Ⅲ相国際共同試験を基に承認されました。承認時に評価されたデータを紹介しますが、一部国内の承認内容と異なる用法及び用量が含まれています。
試験概要6)
目的
中心窩下CNVを伴う滲出型加齢黄斑変性(AMD)患者を対象として、アイリーアの有効性についてラニビズマブ0.5mg4週ごと投与に対する非劣性を検証するとともに、安全性および忍容性についても検討する。
試験対象
中心窩下CNVを伴う滲出型AMD患者1,240例(うち日本人:101例)
インド、アジア太平洋地域(日本含む)、オーストラリア、欧州連合、ラテンアメリカ、イスラエルの26ヵ国、186施設
[主な選択基準]
- 試験眼において、FAにより確認されたAMDに伴う初発の中心窩下CNVの活動性病変(傍中心窩CNV病変を含む)を有する50歳以上の男女
- CNV病変面積が病変全体の50%以上
- 試験眼のETDRS視力表による最高矯正視力文字数が73~25文字(スネレン視力で20/40~20/320) など
試験デザイン
無作為化二重遮蔽実薬対照比較試験
投与方法
対象患者を、アイリーア2mg4週ごと投与群、0.5mg4週ごと投与群、2mg8週ごと投与群、およびラニビズマブ0.5mg4週ごと投与群の4群に無作為に割り付け、硝子体内投与を行った。治療開始時は全群4週ごと投与を3回連続行い、その後は各群の投与スケジュールに従い投与した(固定投与期)。52週経過後は、各群ともに投与間隔を12週に1回を基本とし、再投与基準に合致した場合は、それ以前(4週あるいは8週)に投与できることとした(Modified Quarterly Dosing期)。
主な有効性評価項目
<主要評価項目>
52週目に視力が維持(ETDRS視力表による最高矯正視力文字数の低下が15文字未満)された患者の割合
<探索的評価項目>
96週目(2年目)終了時における視力が維持された患者の割合 など
主な安全性評価項目
有害事象、副作用、重篤な有害事象、投与中止に至った有害事象、死亡、APTC定義による動脈血栓塞栓事象、バイタルサイン など
解析計画
<検証的な解析(第1種の過誤を考慮し、検出力を考慮し例数設計された解析)>
- 主要評価項目(PPS):アイリーア投与群のラニビズマブ投与群に対する非劣性の検証(限界値※110%)。検定の多重性を考慮し、事前に定めた順序(アイリーア2mg4週ごと投与群、アイリーア0.5mg4週ごと投与群、アイリーア2mg8週ごと投与群)に従い検定を行う。
<探索的な解析>
- 探索的評価項目(FAS)
※1:両側95%信頼区間
CNV(choroidal neovascularization):脈絡膜新生血管
FA(fluorescein angiography):フルオレセイン蛍光眼底造影
APTC:Antiplatelet Trialists’ Collaboration
PPS(per protocol set):治験実施計画書に適合した患者集団
FAS(full analysis set):最大の解析対象集団
日本におけるアイリーア(2mg)の中心窩下脈絡膜新生血管を伴う加齢黄斑変性に対する用法及び用量:
アフリベルセプト(遺伝子組換え)として2mg(0.05mL)を1ヵ月ごとに1回、連続3回(導入期)硝子体内投与する。その後の維持期においては、通常、2ヵ月ごとに1回、硝子体内投与する。なお、症状により投与間隔を適宜調節するが、1ヵ月以上あけること。
日本におけるラニビズマブの中心窩下脈絡膜新生血管を伴う加齢黄斑変性症に対する用法及び用量:
ラニビズマブ(遺伝子組換え)として0.5mg(0.05mL)を 1ヵ月毎に連続3ヵ月間(導入期)硝子体内投与する。その後の維持期においては、症状により投与間隔を適宜調節するが、 1ヵ月以上の間隔をあけること。
アイリーア2mg投与群の平均年齢は4週ごと(Q4)投与群で74.1歳、8週ごと(Q8)投与群で73.8歳でした

患者背景および特性6)
(FAS)

CRT(central retinal thickness):中心網膜厚
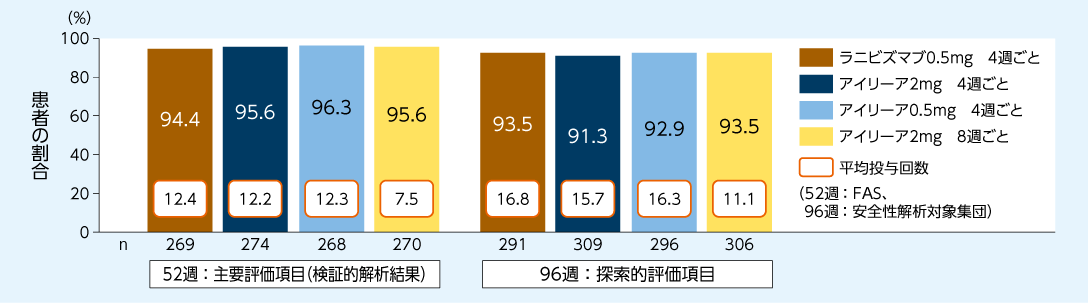
<52週:主要評価項目(検証的解析結果)、96週:探索的評価項目>
アイリーア投与群の視力が維持された患者の割合は、52週目で95%を上回りラニビズマブに対する非劣性が検証され、96週目では91.3~93.5%でした

52週目(PPS)(検証的解析結果)および96週目(FAS)に視力が維持※2された患者の割合(LOCF)6)
※2:ETDRS視力表による最高矯正視力文字数の低下が15文字未満
52週目に視力が維持された患者の群間差(LOCF、PPS)(検証的解析結果)6)

(非劣性限界値:10%)
a)ラニビズマブ投与群-各アイリーア投与群(信頼区間は正規近似を用いた)
LOCF(last observation carried forward):最終評価スコア外挿法
国内外で実施された第Ⅲ相試験[2試験の併合解析(2年間)]におけるアイリーア投与群の主な副作用は、結膜出血26.3%、眼痛8.7%、眼圧上昇4.9%などでした

国内外で実施された第Ⅲ相試験[2試験の併合解析(2年間)]7)
副作用b):
アイリーア投与群で1,824例中896例(49.1%)、ラニビズマブ投与群で595例中311例(52.3%)に認められた。
主な副作用:
アイリーア投与群で結膜出血480例(26.3%)、眼痛158例(8.7%)、眼圧上昇89例(4.9%)、ラニビズマブ投与群で結膜出血171例(28.7%)、眼痛54例(9.1%)、眼圧上昇39例(6.6%)などであった。
<第Ⅲ相試験:VIEW1試験(海外データ) 試験概要>8)
対象:中心窩下CNVを伴う滲出型AMD患者1,217例 方法:VIEW2試験に同じ
b)投与手技に起因する有害事象を含む。電子添文に準じ、併合での集計結果を記載した。
7)バイエル薬品社内資料[VIEW1、VIEW2試験併合解析、2年間]承認時評価資料
8)バイエル薬品社内資料[海外第Ⅲ相試験: VIEW1試験(外国人)]承認時評価資料
VIEW2試験6)
試験薬に関連する重篤な有害事象:
アイリーア投与群で脳血管発作が3例、網膜出血、視力低下、網膜色素上皮裂孔、白内障、一過性脳虚血発作、急性冠動脈症候群、ラクナ梗塞、心筋梗塞、虚血性脳卒中、腎不全が各1例に認められ、ラニビズマブ投与群で網膜色素上皮裂孔が1例に認められた。
試験薬に関連する投与中止に至った有害事象:
アイリーア投与群で脳血管発作c)3例、黄斑変性、視力低下、網膜出血、薬疹、急性冠動脈症候群、ラクナ梗塞、虚血性脳卒中、腎不全、歩行障害c)、会話障害c)が各1例に認められた。
試験薬に関連する死亡:
アイリーア投与群で脳血管発作と虚血性脳卒中が各1例に認められた。
c)脳血管発作の1例と歩行障害および会話障害は同一症例
APTC定義による動脈血栓塞栓事象の発現率は、アイリーア投与群で3.0%に認められました
APTC定義による動脈血栓塞栓事象6)

発現例数(発現率%)
d) アイリーア2mg4週ごと、0.5mg4週ごと、2mg8週ごと投与群の3群合算により検討
e) すべての有害事象のうち、APTC定義により判定された動脈血栓塞栓事象
まとめ
高齢はATEのリスク因子であり、久山町研究において、加齢によりATE発症率が上昇したと報告されています1-3)。
アイリーア(2mg)投与患者には高齢者が含まれており、市販後に長期安全性が検討されました(最長3年)4)。
VIEW2試験6)において、アイリーア投与群の視力が維持された患者の割合は、52週目で95%を上回りラニビズマブに対する非劣性が検証され(検証的解析結果)、96週目では91.3~93.5%でした。
VIEW1、VIEW2の2試験併合解析(2年間)7)での副作用は、アイリーア投与群で1,824例中896例(49.1%)、ラニビズマブ投与群で595例中311例(52.3%)に認められました。
VIEW2試験6)において、APTC定義による動脈血栓塞栓事象の発現率は、アイリーア投与群3.0%、ラニビズマブ投与群2.4%でした。
<参考>
nAMD患者における心筋梗塞および虚血性脳卒中の発症率
nAMD患者におけるATEの発症率※3は、心筋梗塞で2.2%/年、 虚血性脳卒中で3.5%/年と報告されています(海外データ)
● ただし、加齢や合併症、既往歴により、発症率は上昇しました
※3:入院患者
心筋梗塞の発症率※3 9)

虚血性脳卒中の発症率※3 9)

対象:
2001~2003年のMedicare(米国の健康保険制度)データベースより抽出された新規のnAMD患者15,771例(65歳以上、nAMDの診断が 2回あり、最初の診断の前に少なくとも1年間のデータが存在する)および対照患者46,408例(主要な眼疾患の診断を受けておらず、年齢、 人種、性別、データの期間が一致する患者を3:1の割合となるよう抽出)
方法:
対象患者における心筋梗塞および虚血性脳卒中の年間発症率をレトロスペクティブに評価した。
9) Alexander SL, et al.: Ophthalmology. 2007; 114: 2174-2178.
再審査結果のお知らせ(2022年9月7日付け)
再審査対象適応症

アイリーア(2mg)の適応症のうち、「中心窩下脈絡膜新生血管を伴う加齢黄斑変性」、「病的近視における脈絡膜新生血管」、「糖尿病黄斑浮腫」、「網膜静脈閉塞症に伴う黄斑浮腫」につきまして、「再審査結果」の通知がありましたのでご案内申し上げます。
再審査における有効性・安全性の評価において、現時点で変更すべき問題はなく、「効能又は効果」および「用法及び用量」に変更はございません。
製造販売後調査等の結果および再審査結果の詳細につきましては、PMDAホームページに掲載されております「再審査報告書」よりご確認いただくことができます。
本剤の調査にご協力賜りましたことに重ねて御礼申し上げますとともに、今後ともご愛顧を賜りますよう、お願い申し上げます。
アイリーア(2mg)は2012年に発売されて以来、臨床試験や使用成績調査など
豊富なエビデンス、国内使用実績を持つ薬剤です



