日本人を含む第Ⅲ相国際共同試験:FIREFLEYE試験
(奏効割合の閾値66%に 対する優越性の検証またはレーザー治療に対する非劣性の検証)
バイエル薬品社内資料[日本人を含む第Ⅲ相国際共同試験:FIREFLEYE試験]承認時評価資料
アイリーア(2mg)の承認された効能又は効果(抜粋):未熟児網膜症*
アイリーア(2mg)の承認された用法及び用量(抜粋):
〈未熟児網膜症〉
アフリベルセプト(遺伝子組換え)として1回、0.4mg(0.01mL)を硝子体内投与する。なお、必要な場合は再投与できるが、1ヵ月以上の間隔をあけること。
*
本適応症は「アイリーア®硝子体内注射液40mg/mL」の効能又は効果として承認されています。「アイリーア®硝子体内注射用キット40mg/mL」の効能又は効果としては承認されていません
本ページでは「アイリーア(2mg)」を「アイリーア」と記載しています。
試験概要

【実施地域】FIREFLEYE試験:アジア太平洋地域(日本含む)、欧州、ラテンアメリカ、中東の27ヵ国、64施設
目的
ROP患者におけるアイリーアと網膜光凝固術の有効性を比較するために、アイリーアの奏効割合の閾値に対する優越性もしくはレーザー治療に対する非劣性を検証するとともに、安全性および忍容性についても検討する
対象
ROP患者118例(うち日本人:17例)
[主な選択基準]
- 在胎週数が32週以下または出生体重が1500g以下
- ROP国際分類a)による下記のいずれかの所見を少なくとも片眼に有し、未治療
- zoneⅠ stage1+、2+、3または3+、もしくは
- zoneⅡ stage2+または3+、もしくは
- Aggressive posterior ROP(AP-ROP)※1
- 試験治療日の体重が800g以上 など
[主な除外基準]
患者単位:
- 染色体異常、遺伝子疾患または遺伝的症候群を有する、もしくはそれらが疑われる
- 臨床的に留意すべき神経疾患(グレード3以上の脳室内出血、脳室周囲白質軟化症、留意すべき視神経機能障害を及ぼす先天的脳病変、または留意すべき頭蓋内圧亢進を伴う重度の水頭症、など)を有する など
眼単位:
- 部分的または完全な網膜剥離に進行したROP(stage4または5)を有する
- zoneⅢにのみROP病変を有する
- 試験治療または主要評価項目の判定に影響を及ぼす可能性のある眼の異常がある
- ROPに対して外科的または非外科的な治療(抗VEGF薬の硝子体内投与、網膜光凝固術または冷凍凝固術、硝子体手術)の既往がある
デザイン
無作為化非遮蔽網膜光凝固術対照比較試験
投与方法
対象患者を、アイリーア投与群およびレーザー治療群の2群に2:1の比で無作為に割り付けた。
- アイリーア投与群:適格と判定された片眼または両眼に、初回治療として1眼につきアイリーア0.4mg/0.01mLの単回硝子体内投与を行った。両眼への投与が必要な場合は、同日に行った。再投与基準に適合した場合は、28日以上の間隔をあけて各眼につき2回まで追加投与を実施できた。また、レスキュー治療基準に適合した場合は、網膜光凝固術によるレーザー治療を実施した。
- レーザー治療群:適格と判定された片眼または両眼に網膜光凝固術によるレーザー治療を実施した。治験担当医師の判断に基づき、可能な限り治療を完遂するが、試験治療開始から1週間以内に複数回の治療が必要となった場合は、1回の治療として取り扱った。再治療基準に適合した場合はレーザー治療を実施し、レスキュー治療基準に適合した場合はアイリーア投与を実施した。

[アイリーア投与群の再投与基準]
以下の両方に適合する場合:
- 治療を要するROPが存在
- 前回のアイリーアの硝子体内投与から28日以上経過
[アイリーア投与群のレスキュー治療基準]
以下のいずれかに適合する場合:
- 前回のアイリーアの硝子体内投与から27日以内に、前回の投与前に実施された検査時と比較してROP所見が悪化
- アイリーアの硝子体内投与が計3回実施され、最後の硝子体内投与から28日以上経過した時点で治療を要するROPが存在
[レーザー治療群の再治療基準]
以下の両方に適合する場合:
- 治療を要するROPが存在
- 眼底検査の結果、治験担当医師によって網膜光凝固術が不十分であると判定
[レーザー治療群のレスキュー治療基準]
眼底検査の結果、治験担当医師によって網膜光凝固術が十分であったと判定され、かつ以下のいずれかに適合する場合:
- 網膜光凝固術の前に実施された検査時と比較してROP所見が悪化
- 網膜光凝固術から28日以上経過した後も治療を要するROPが持続
主な有効性評価項目
主要評価項目:
試験治療開始から24週目に活動性のROPがなく、かつ不良な形態学的転帰もない患者の割合(奏効割合、奏効確率※2)
副次評価項目:
- 試験治療開始から24週目までの二次治療の必要性※3
- 試験治療開始から24週目までのROPの再発※4
- 試験治療開始から24週目までにアイリーアを投与した回数
- 試験治療開始から24週目までにレーザー治療を実施した回数 など
事前に規定したその他の評価項目:
- 試験治療の所要時間※5
- 鎮静または全身麻酔の必要性※6
- 2回以上のアイリーア投与の必要性※7
- 試験治療開始から24週目にかけてのplus diseaseの退縮※8、網膜前面の血管形成隆起の退縮※9、および隆起部位を超えての網膜血管の発達※10
- 試験治療開始から24週目にかけてのstage4または5のROPへの進行※11
- 24週目までの必要来院回数 など
その他の探索的評価項目:
試験治療開始から24週目までにROPが完全に退縮した後の再発※12
主な安全性評価項目
有害事象、副作用、重篤な有害事象、投与中止に至った有害事象、死亡 など
解析計画
日本の検証的な解析
主要評価項目(FAS):アイリーア投与群における奏効割合の閾値に対する優越性の検証(両側95%信頼区間の下限値が閾値[66%]を超える)
日本以外の国または地域の検証的な解析
主要評価項目(FAS):アイリーア投与群における奏効確率※2のレーザー治療群に対する非劣性の検証(群間差が-5%以上となる確率が95%以上)
探索的な解析
主要評価項目(FAS):アイリーア投与群およびレーザー治療群の奏効割合の差
副次評価項目(FAS)
事前に規定したその他の評価項目(FAS)
その他の探索的評価項目(FAS)
部分集団解析:医師判定による試験治療開始時のROPのzone別の主要評価項目の解析
日本人の部分集団解析
FAS(full analysis set):いずれかの試験治療を受け、試験治療開始時および試験治療開始後に少なくとも1回、有効性が評価されたすべての患者
※1 本試験は国際分類第2版に基づき実施されたためAP-ROPと表記されている〔国際分類第3版ではAggressive ROP(A-ROP)〕。
※2 奏効確率はベイズ統計モデルにより推定した。
※3 必要であった確率(事後分布の中央値)、必要であった患者の割合、必要であった眼の割合
※4 再発した確率(事後分布の中央値)、再発した患者の割合、再発した眼の割合
※5 アイリーアの投与に要した総時間、レーザー治療に要した総施行時間
※6 全身麻酔を受けた患者の割合、全身麻酔を受けた眼の割合、鎮静剤投与を受けた患者の割合、鎮静剤投与を受けた眼の割合、局所麻酔を受けた患者の割合、局所麻酔を受けた眼の割合
※7 必要であった患者の割合、必要であった眼の割合
※8 24週目にplus diseaseの退縮を認めた眼の割合
※9 試験治療開始時にROPありで、24週目にROPなしと判定された眼の割合
※10 試験治療開始時にzoneⅠまたはⅡで、24週目にROPなしと判定された眼の割合
※11 試験治療開始後のいずれかの評価時期にstage4または5のROPに進行した眼の割合
※12 再発した確率(事後分布の中央値)、再発した患者の割合、再発した眼の割合
a)An International Committee for the Classification of Retinopathy of Prematurity: Arch Ophthalmol 2005; 123: 991-999.
試験対象例数と各群の患者の内訳

試験完了:
24週目または27週目(再投与/再治療またはレスキュー治療が実施された場合)における評価を完了した患者
未熟児網膜症の用法及び用量
アフリベルセプト(遺伝子組換え)として1回、0.4mg(0.01mL)を硝子体内投与する。なお、必要な場合は再投与できるが、1ヵ月以上の間隔をあけること。
患者背景および特性(SAF)

※ 試験治療開始時の月経後年齢=出生時の在胎期間+試験治療開始時の暦年齢
SAF(safety analysis set):安全性解析対象集団

例数(%)または眼数(%)
※1 ROPの病期(zoneおよびstage)がより進行している眼に基づき分類した。
より進行している眼の選択基準:AP-ROPまたはzoneがより低い眼とし、同じ場合はstageがより高い眼を選択した。
主要解析に適合する眼のみ示した。
※2 AP-ROP患者を除く。
アイリーア投与群の奏効割合の両側95%信頼区間の下限値は72.2%で、事前に規定した閾値(66%)を超えており、奏効割合の閾値に対するアイリーア投与群の優越性が検証されました
試験治療開始から24週目に活動性のROPがなく、かつ不良な形態学的転帰もない患者の割合(奏効割合)※1,2(FAS):主要評価項目(日本の検証的な解析)

* 探索的な解析
※4 Clopper-Pearsonの正確な両側95%信頼区間 ※5 漸近的な両側95%信頼区間 ※6 アイリーア投与群-レーザー治療群
レーザー治療群に対するアイリーア投与群の群間差が‒5%以上となる確率は88.4%で、事前に規定した基準(95%以上)を下回っており、レーザー治療群に対するアイリーア投与群の非劣性は検証されませんでした
試験治療開始から24週目に活動性のROPがなく、かつ不良な形態学的転帰もない患者の割合(奏効確率)※1,2(FAS):主要評価項目(日本以外の国または地域の検証的な解析)
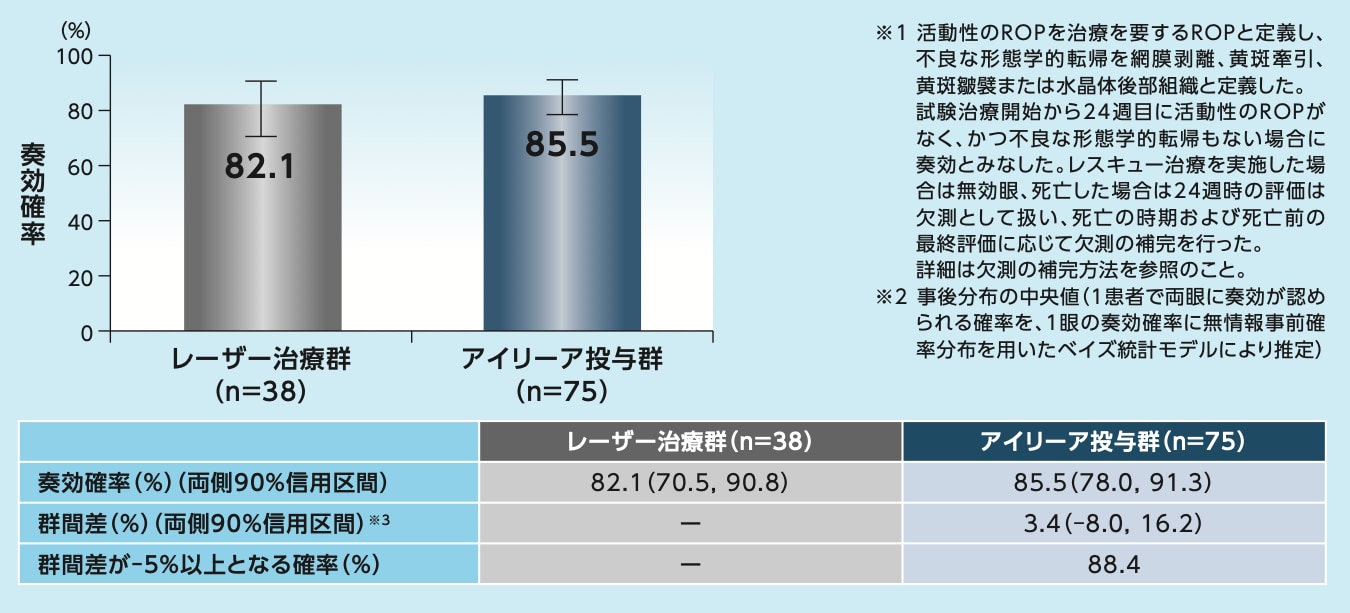
※3 アイリーア投与群-レーザー治療群
非劣性基準:群間差が-5%以上となる確率が95%以上
欠測の補完方法
欠測の補完については、以下の取扱いとした。なお、試験中止前に不良な形態学的転帰が認められない眼またはレスキュー治療が行われなかった眼に限り適用となる。
◆試験中止前の最終来院時に活動性のROPが認められず、zoneⅡに完全な血管形成が認められた場合(アイリーア投与群)または網膜光凝固術が完了していた場合(レーザー治療群)は、その眼について奏効と判定した。
◆16週目以降に中止となった場合は、中止前最後に認められたROPの病期を用いて補完し、その眼に対する効果を判定した。
◆16週目より前に中止した場合は、欠測データを以下のとおり補完した。
- 有効性の欠如が原因で中止となったことが明確に記録されている場合は、その眼について無効と判定した。
- それ以外の場合は、試験治療群および最初のROPの病期判定(zoneⅠ、zoneⅡまたはAP-ROP)に基づき、多重補完法を用いた。
試験治療開始時のzone別の奏効割合は、AP-ROPではアイリーア投与群で71.4%、レーザー治療群で5例中4例、zoneⅠではそれぞれ66.7%、7例中5例、zoneⅡではそれぞれ91.3%、88.5%でした
奏効割合(FAS):主要評価項目の部分集団解析

※1 評価例数が10例未満の場合、%は記載していない。
※2 Clopper-Pearsonの正確な両側95%信頼区間
二次治療が必要であった患者の割合は、アイリーア投与群で10.7%、レーザー治療群で13.2%、眼の割合はそれぞれ8.2%、12.5%でした
試験治療開始から24週目までの二次治療※1の必要性(FAS):副次評価項目

※1 治験実施計画書で定義したレスキュー治療および他のROPに対する外科的または非外科的治療(例:併用療法として記録された、抗VEGF薬の硝子体内投与、網膜光凝固術、冷凍凝固術または硝子体手術)を含めた。
※2 ベイズ統計モデルにより推定
ROPを再発した患者の割合は、アイリーア投与群で26.7%、レーザー治療群で10.5%、眼の割合はそれぞれ21.9%、8.3%でした
試験治療開始から24週目までのROPの再発※1(FAS):副次評価項目
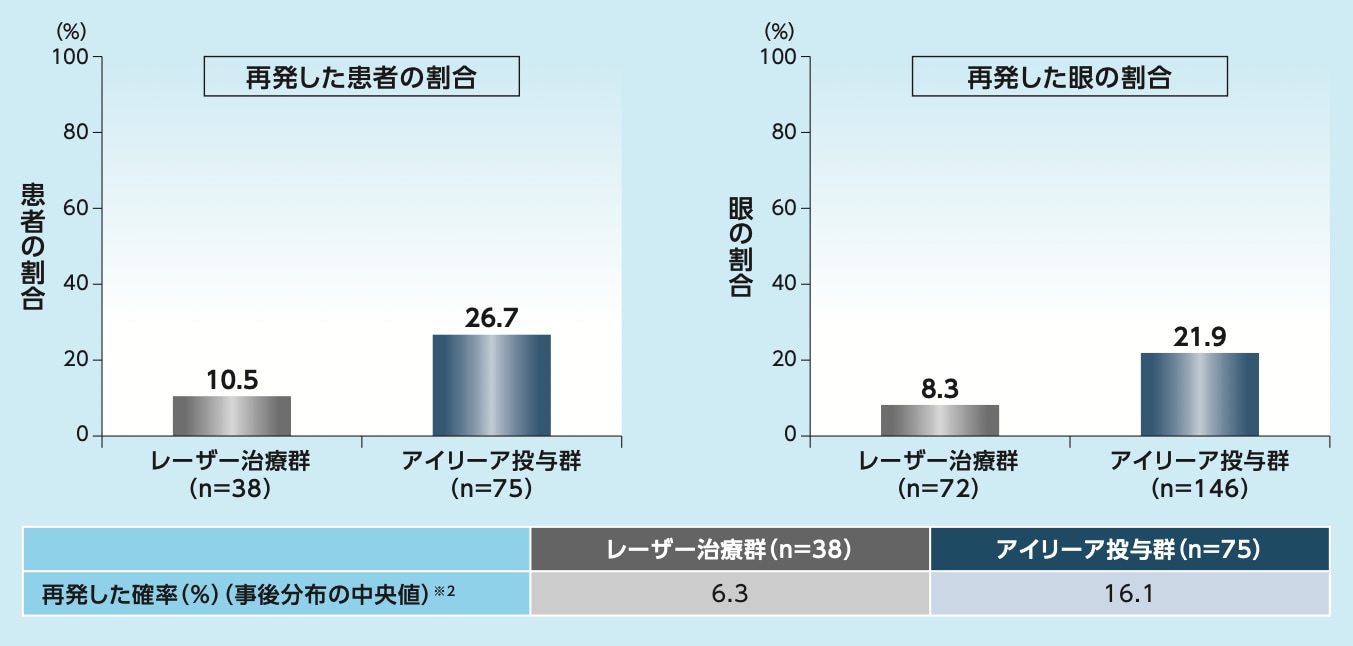
※1 「治療を要する活動性のROPなし」と治験担当医師により判定された後に再投与、再治療またはレスキュー治療が必要となった場合であり、ROPが過去に治療を必要としないstageに回復したが再度悪化し、ROPの追加治療が必要となった場合を指す。
※2 ベイズ統計モデルにより推定
アイリーアの投与回数は、アイリーア投与群では患者別で1~4回であり、1眼あたりの投与回数は1回が82.2%を占めました
試験治療開始から24週目までにアイリーアを投与した回数(FAS):副次評価項目

※ レーザー治療群では38例72眼中4例8眼にアイリーアをレスキュー治療として投与した。
レーザー治療回数は、レーザー治療群では患者別で1~6回であり、1眼あたりの治療回数は1回が90.3%を占めました
試験治療開始から24週目までにレーザー治療を実施した回数(FAS):副次評価項目

※ アイリーア投与群では75例146眼中5例7眼にレーザー治療をレスキュー治療として実施した。
FIREFLEYE試験(24週間)における安全性(SAF)
副作用※発現率
アイリーアを投与された79例(アイリーア投与群75例、レーザー治療群4例)中17例(21.5%)に認められました
主な副作用
結膜出血4例(5.1%)、網膜出血、注射部位出血、眼圧上昇 各3例(3.8%)
有害事象発現率
アイリーア投与群で75例中56例(74.7%)、レーザー治療群で38例中28例(73.7%) に認められました
主な有害事象
アイリーア投与群:網膜出血5例(6.7%)、網膜剥離、結膜出血 各4例(5.3%)
レーザー治療群:網膜出血5例(13.2%)、結膜炎4例(10.5%)、眼瞼浮腫、臍ヘルニア、無呼吸、皮下出血 各3例(7.9%)、網膜剥離、貧血、新生児貧血、細菌性疾患キャリアー、乳児無呼吸 各2例(5.3%)
試験薬に関連する重篤な有害事象
アイリーア投与群:本試験においては認められませんでした
レーザー治療群:網膜剥離1例
試験薬に関連する投与中止に至った有害事象、試験薬に関連する死亡
本試験においては認められませんでした
※ 投与手技に起因する有害事象を含む
FIREFLEYE試験における日本人の部分集団解析
患者背景および特性(SAF)


例数(%)または眼数(%)
※1 ROPの病期(zoneおよびstage)がより進行している眼に基づき分類した。
より進行している眼の選択基準:AP-ROPまたはzoneがより低い眼とし、同じ場合はstageがより高い眼を選択した。
主要解析に適合する眼のみ示した。
※2 AP-ROP患者を除く。
日本人集団における奏効割合は、アイリーア投与群で90.0%、レーザー治療群で6例中5例でした
奏効割合(FAS):主要評価項目の部分集団解析

※1 評価例数が10例未満の場合、%は記載していない。
※2 Clopper-Pearsonの正確な両側95%信頼区間
※3 アイリーア投与群の1例は試験治療開始後144日目(試験治療日を含む)に死亡したため、日本の有効性主要解析では無効例として取り扱った。
試験治療開始から24週目までの二次治療※1の必要性、試験治療開始から24週目までのROPの再発※2、試験治療開始から24週目までにアイリーアを投与した回数、試験治療開始から24週目までにレーザー治療を実施した回数(FAS):副次評価項目の部分集団解析

※1 治験実施計画書で定義したレスキュー治療および他のROPに対する外科的または非外科的治療(例:併用療法として記録された、抗VEGF薬の硝子体内投与、網膜光凝固術、冷凍凝固術または硝子体手術)を含めた。
※2 「治療を要する活動性のROPなし」と治験担当医師により判定された後に再投与、再治療またはレスキュー治療が必要となった場合であり、ROPが過去に治療を必要としないstageに回復したが再度悪化し、ROPの追加治療が必要となった場合を指す。
※3 評価例数が10例未満の場合、%は記載していない。
※4 日本人集団でレスキュー治療を受けた患者はいなかった。
FIREFLEYE試験(24週間)の日本人集団における安全性(SAF)
有害事象発現率
アイリーア投与群で10例中7例(70.0%)、レーザー治療群で6例中5例(83.3%)に認められました
有害事象
アイリーア投与群:おむつ皮膚炎2例(20.0%)、頻脈、クッシング様症状、腹部膨満、口唇炎、胃出血、発熱、低カリウム血症、代謝性アシドーシス、四肢拘縮、脳室内出血、慢性呼吸疾患、肺高血圧症、皮膚炎、乳児湿疹 各1例(10.0%)
レーザー治療群:眼瞼浮腫、皮下出血 各3例(50.0%)、網膜出血2例(33.3%)、虹彩癒着、腸炎、気道感染、喉頭狭窄 各1例(16.7%)
試験薬に関連する重篤な有害事象、試験薬に関連する投与中止に至った有害事象、試験薬に関連する死亡
本試験の日本人集団においては認められませんでした



