アイリーア8mgによるnAMD治療継続の負担軽減
nAMD (neovascular age-related macular degeneration):滲出型加齢黄斑変性
アイリーア8mgの承認された効能又は効果(抜粋):中心窩下脈絡膜新生血管を伴う加齢黄斑変性
Sustainable Disease Control(SDC)
黄斑疾患治療において、疾患活動性を示す血管新生や血管透過性亢進などの病態を持続してコントロールし、長期的に視力低下を防ぐことが重要であり、SDCとはその治療達成を目指した治療目標です。

監修:鹿児島大学大学院 医歯学総合研究科 先進治療科学専攻 感覚器病学講座 眼科学分野 教授 坂本 泰二 先生
nAMDの完治は不可能であり、病状や患者負担を考慮し、患者と共に持続可能な管理方法を選択することが求められています
新生血管型加齢黄斑変性の診療ガイドライン(2024年)
VII 治療と管理
3.長期管理とロービジョンケア
現時点で新生血管型AMDの完治は不可能であり、適切な治療と長期管理を行わないと不可逆的な視力低下を容易に引き起こす。MNVの活動性が一時的に落ち着いていても長期経過で再発すること、滲出を繰り返すことで萎縮性変化や線維性瘢痕を合併し視力が著しく低下すること、僚眼にもMNVが高率に生じることなどを念頭に、管理を行う必要がある。一方で、病状や患者負担を考慮し、患者と共に持続可能な管理方法を選択することが求められる。高度な視機能低下を来した患者に対しては、積極的にロービジョンケアを行うことが勧められる1)。
MNV(macular neovascularization):黄斑新生血管
1) Flaxel CJ, et al.:Ophthalmology. 2020;127:P1-P65.
日本網膜硝子体学会新生血管型加齢黄斑変性診療ガイドライン作成ワーキンググループ:
新生血管型加齢黄斑変性の診療ガイドライン, 日眼会誌. 2024;128:680-698. より抜粋

nAMD患者の治療を中断した割合は治療開始後2年間で26%に及び、治療の中断は治療開始後3年目以降も報告されています(海外データ)
フォローアップ中に治療を中断した割合
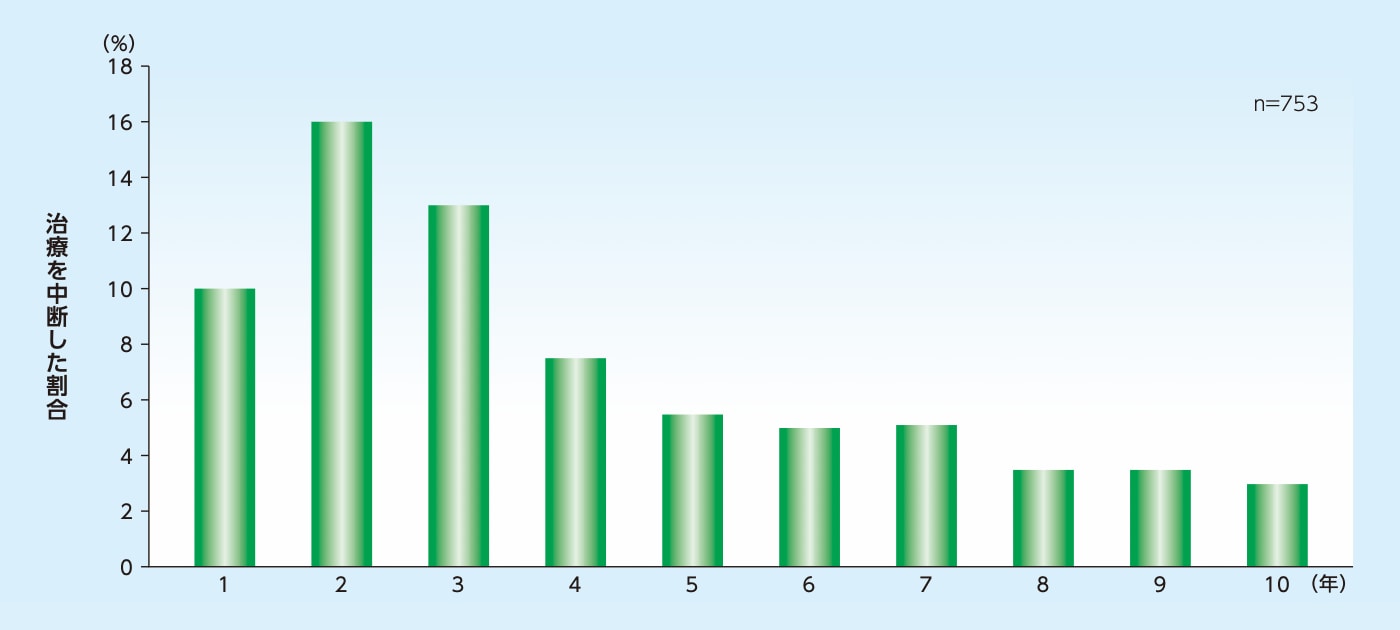
対象
抗VEGF薬による治療を開始したnAMD患者1,046例(うち治療を中断した753例)
方法
電子処方データベースを用いた後ろ向きコホート研究。2006年11月〜2009年12月に抗VEGF薬による治療を開始した患者を特定し、主要評価項目として治療開始10年後の視力の変化、副次評価項目として投与回数などを検討した。
利益相反
著者にBayerよりコンサルタント料を受領している者が含まれる。
Spooner K, et al.:Ophthalmol Retina. 2021;5:511-518.
抗VEGF薬による治療中断後、12ヵ月間で38.2%、24ヵ月間で50.0%に再燃※が認められたことが報告されています(国内データ)
※ OCTまたは眼底検査による網膜下液、網膜内液、または網膜出血の検出
治療中断後の再燃までの期間と割合

対象
2年以上抗VEGF治療を12〜16週ごとに受け、少なくとも48週間にわたり滲出や出血が認められなかったnAMD患者34例(典型AMD21例、PCV13例)
方法
三重大学医学部付属病院における診療記録を用いた後ろ向き研究(2009年4月1日〜2018年12月31日)。治療中断後にフォローアップを実施し、再燃(OCTまたは眼底検査による網膜下液または網膜内液、網膜出血の検出)が認められた割合および再燃までの期間などを評価した。
利益相反
著者にバイエル薬品、参天製薬より研究費、講演料、謝礼等を受領している者が含まれる。
Matsubara H, et al.:Graefes Arch Clin Exp Ophthalmol. 2022;260:1867-1876. https://creativecommons.org/licenses/by/4.0/
nAMDおよびDME患者の治療アドヒアランスの障壁として最も多く報告されたのは時間的負担(通院・待ち時間)であり、特に治療経過の長い患者で多く報告されました(海外データ)
硝子体内投与の治療アドヒアランスの障壁※による影響を受けた患者の割合

対象
ドイツで抗VEGF薬の硝子体内投与による治療を受けているnAMD患者156例およびDME患者78例の計234例
方法
硝子体内投与による治療における患者の治療アドヒアランスに影響を与える障壁を評価するために設計された質問票であるABQ-IVTを用いて対象患者に質問を実施した。回答は「強く同意する」を1、「概ね同意する」を2、「概ね同意しない」を3、「まったく同意しない」を4とする4段階のリッカート尺度が用いられた。特定の障壁の存在を示す項目は逆転処理され、スコアが高いほど治療アドヒアランスの障壁による影響が大きいと判断された。逆転処理後の回答が2を超える場合(「概ね同意しない」または「まったく同意しない」)、患者が影響を受けているとみなした。
利益相反
本研究はBayer Vital GmbHの資金により実施された。著者にBayer Vital GmbH、Bayer、Bayer HealthcareあるいはBayer Vitalから研究助成金や謝礼等を受領している者が含まれる。
ABQ(adherence barriers questionnaire)、IVT(intravitreal anti-VEGF injection)
Müller S, et al.:Int J Retina Vitreous. 2021;7:43. より一部抜粋 https://creativecommons.org/licenses/by/4.0/
日本人を含む第III相国際共同試験:PULSAR試験
(アフリベルセプト2mgに対する非劣性の検証)

バイエル薬品社内資料[日本人を含む第Ⅲ相国際共同試験:PULSAR試験]承認時評価資料、電子添文改訂時評価資料(96週)
試験概要
【実施地域】アジア太平洋地域(日本含む)、オーストラリア、欧州、中東、南米、北米の27ヵ国、251施設
目的
中心窩下CNVを伴うnAMD患者を対象に、アイリーア8mg12週間隔または16週間隔投与による有効性についてアフリベルセプト2mg8週間隔投与に対する非劣性を検証するとともに、安全性についても検討する
試験対象
中心窩下CNVを伴うnAMD患者1,012例※1(うち日本人:98例)
※1
48および60週目解析では試験薬投与を受けていない1例の患者が無作為割り付け例数に含まれていなかった。
[主な選択基準]
- 試験眼において評価されたnAMDに続発する中心窩下CNVの活動性病変(中心窩に影響を及ぼす傍中心窩病変を含む)を有する 50歳以上の男女
- 試験眼の総CNV病変面積(classicおよびoccultの両CNV病変を含む)が病変全体の50%を超える
- 試験眼のETDRS視力表による最高矯正視力文字数が78〜24文字(スネレン視力で20/32〜20/320)であり、nAMDが主な原因であると判断される最高矯正視力文字数の減少がある
- OCTで、試験眼の中心窩領域に影響を及ぼすIRFおよび/またはSRFが認められる など
[主な除外基準]
- 試験眼に、nAMD以外の原因によるCNVを有する
- 試験眼に、蛍光眼底造影により評価した総病変面積が12視神経乳頭面積(12視神経乳頭面積は30.5mm2とし、病変には出血、瘢痕、新生血管を含む)を超える
- 試験眼にコントロール不良の緑内障(抗緑内障薬による治療にもかかわらず眼圧が25mmHgを超える場合)を有する
- 試験眼に特発性または自己免疫性ぶどう膜炎の既往歴を有する
- スクリーニング来院前12週以内に、いずれかの眼に、眼内の炎症または感染を有する
- 試験眼に対する血管新生阻害薬による治療歴を有する
- いずれかの眼における、糖尿病網膜症、糖尿病黄斑浮腫またはnAMD以外の網膜血管疾患の既往歴または臨床所見を有する
- コントロール不良の高血圧(収縮期血圧160mmHg超または拡張期血圧95mmHg超)を有する
- スクリーニング来院前24週以内に脳血管発作または心筋梗塞の既往歴を有する など
試験デザイン
無作為化二重遮蔽実薬対照比較試験
投与方法
対象患者をアフリベルセプト2mg8週間隔投与群、アイリーア8mg12週間隔投与群、アイリーア8mg16週間隔投与群の3群に1:1:1の比で無作為に割り付け※2、硝子体内投与した。試験薬の投与は片眼のみに実施した。
- 2mg8週間隔投与群:アフリベルセプト2mgを4週間隔で連続3回投与後、8週間隔で投与
- 8mg12週間隔投与群:アイリーア8mgを4週間隔で連続3回投与後、12週間隔で投与
- 8mg16週間隔投与群:アイリーア8mgを4週間隔で連続3回投与後、16週間隔で投与
8mg12週間隔投与群および16週間隔投与群の試験薬投与の詳細は、下部の「■投与スケジュール、用法用量の変更」を参照のこと。
※2
地域(日本、その他の地域)およびベースラインの最高矯正視力文字数(60文字未満、60文字以上)に基づき層別化した。
主な有効性評価項目
主要評価項目:
48週目における最高矯正視力文字数のベースラインからの変化量
主な副次評価項目:
60週目における最高矯正視力文字数のベースラインからの変化量
16週目に中心窩領域にIRFおよびSRFが認められなかった患者の割合
その他の副次評価項目:
48週目に中心窩領域にIRFおよびSRFが認められなかった患者の割合
48週目におけるCRTのベースラインからの変化量 など
探索的評価項目:
96週目における最高矯正視力文字数のベースラインからの変化量
8mg12週間隔投与群において48週目および96週目まで投与間隔が12週間隔以上であった患者の割合
8mg16週間隔投与群において48週目および96週目まで投与間隔が16週間隔以上であった患者の割合
その他の副次評価項目(48週目の評価)に設定した評価項目の60週目および96週目の評価 など
主な安全性評価項目
有害事象、副作用、重篤な有害事象、投与中止に至った有害事象、死亡、眼内炎症反応、眼圧上昇事象、眼圧上昇の程度、高血圧事象、APTC定義による動脈血栓塞栓事象 など
事前に規定されたその他の評価項目
- 8mg12週間隔投与群および8mg16週間隔投与群において16週目または20週目に投与間隔が8週間隔へ短縮となった患者の割合
- 8mg12週間隔投与群および8mg16週間隔投与群において48週目および96週目までにいずれかの時点で投与間隔が短縮となった患者の割合
- 8mg12週間隔投与群において48週目および96週目に次回予定された投与間隔が12週間隔以上であった患者の割合
- 8mg16週間隔投与群において48週目および96週目に次回予定された投与間隔が16週間隔以上であった患者の割合
- 48週目および96週目までの投与回数 など
解析計画
主要評価項目および主な副次評価項目において、検定全体のfamily-wiseの第1種の過誤確率を0.025(片側検定)に制御した。主要評価項目および主な副次評価項目における検定の多重性の調整には、下記の階層的検定手順を用い、より上位の階層にランク付けされた仮説を棄却した後にのみ、有意水準0.025(片側)で続く下位の仮説の検定を可能とした※3。
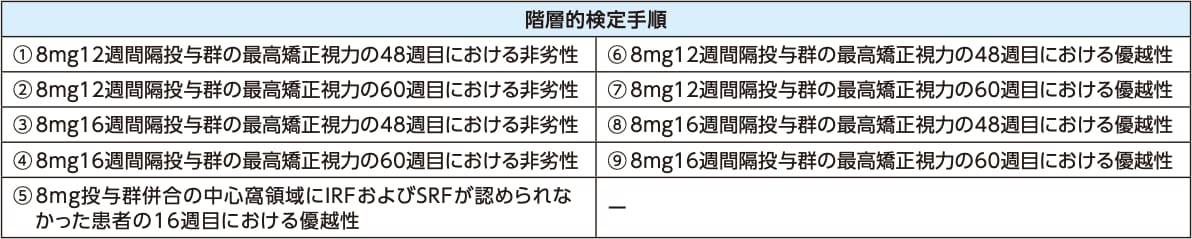
いずれも2mg8週間隔投与群に対する比較検定
階層的検定手順に基づく仮説はすべての患者が60週目を完了(または早期中止)した後に評価した。
主要評価項目を含む48週目までの有効性評価について、60週目完了後のデータによる再解析は実施しなかった。
※3 ⑥において優越性が示されなかったため、検定を終了した。
検証的な解析(第1種の過誤を考慮し、検出力を考慮し例数設計された解析)
主要評価項目(FAS):
8mg12週間隔投与群および8mg16週間隔投与群の2mg8週間隔投与群に対する非劣性の検証(非劣性限界値-4文字)
第1種の過誤を考慮した解析(検出力を考慮した例数設計はされていない)
主な副次評価項目(FAS):
「60週目における最高矯正視力文字数のベースラインからの変化量」は主要評価項目と同一の方法により解析
「16週目に中心窩領域にIRFおよびSRFが認められなかった患者の割合」は8mg投与群併合の2mg8週間隔投与群に対する優越性の検討
探索的な解析
その他の副次評価項目(FAS)、探索的評価項目(FAS、SAF)、事前に規定されたその他の評価項目(SAF) など
事後解析†
8mg12週間隔投与群および8mg16週間隔投与群における、52週目以降に投与間隔を20週まで延長し、96週目まで20週以上の投与間隔を維持した患者の割合についての解析 など
†
本事後解析は、電子添文の「17. 臨床成績」における記載に関連し、電子添文改訂の審査過程において評価を受けた解析結果であるため掲載しています。
CNV(choroidal neovascularization):脈絡膜新生血管、ETDRS(Early Treatment Diabetic Retinopathy Study):糖尿病網膜症早期治療研究、OCT(optical coherence tomography):光干渉断層計、IRF(intraretinal fluid):網膜内液、SRF(subretinal fluid):網膜下液、CRT(central retinal thickness):中心網膜厚、APTC(Antiplatelet Trialists’ Collaboration)
● 中心窩領域:中心窩から直径1mmの範囲
● 中心網膜厚:中心窩領域の網膜厚
● FAS(full analysis set):最大の解析対象集団。無作為化され、少なくとも1回の試験薬投与を受けたすべての患者。無作為割り付けされた群に基づき解析を行った。
● SAF(safety analysis set):安全性解析対象集団。無作為化され、少なくとも1回の試験薬投与を受けたすべての患者。実際の投与に基づき解析を行った。
投与スケジュール、用法用量の変更
8mg12週間隔投与群および16週間隔投与群では、16週目以降、DRM基準に従い投与間隔を変更した。

DRM(dose regimen modification):用法用量変更
DRM基準(短縮:16週目以降):
「最高矯正視力文字数の12週目からの5文字超低下」かつ「CRTの12週目からの25µm超増加、または中心窩に新たな出血、または新たな新生血管が発現」
DRM基準(延長:52週目以降):
「最高矯正視力文字数の12週目からの低下が5文字未満」かつ「OCTで中心窩領域に滲出液が認められない」かつ「中心窩に新たな出血および新生血管の発現がない」
投与間隔の短縮および延長の基準のいずれも満たさなかった患者は投与間隔を維持した。
中心窩下脈絡膜新生血管を伴う加齢黄斑変性の用法及び用量
アフリベルセプト(遺伝子組換え)として8mg(0.07mL)を4週ごとに1回、通常、連続3回(導入期)硝子体内投与するが、症状により投与回数を適宜減じる。その後の維持期においては、通常、16週ごとに1回、硝子体内投与する。なお、症状により投与間隔を適宜調節するが、8週以上あけること。
患者背景および特性(FAS)

※1 読影施設で評価した
※2 適切な装置を有する施設においてインドシアニングリーン蛍光眼底造影により任意で評価した
※3 フルオレセイン蛍光眼底造影/眼底撮影を用いて評価した
PCV(polypoidal choroidal vascularization):ポリープ状脈絡膜血管症、RAP(retinal angiomatous proliferation):網膜血管腫状増殖
Focus on Vision Gain
主要評価項目
(検証的解析結果)
48週目における最高矯正視力文字数のベースラインからの変化量は、8mg12週間隔投与群で+6.1文字、8mg16週間隔投与群で+5.9文字であり、2mg8週間隔投与群(+7.0文字)に対する非劣性が検証されました
最高矯正視力文字数のベースラインからの変化量(MMRM、FAS)
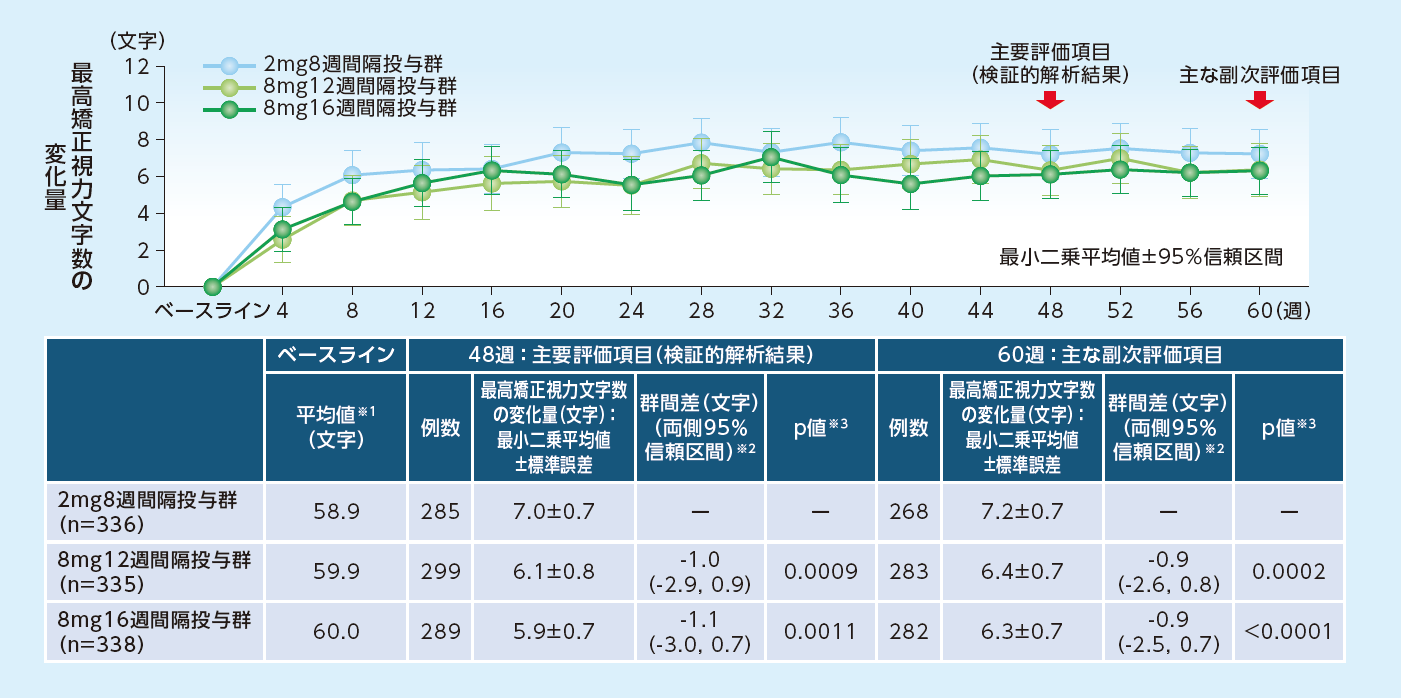
※1 実測値 ※2 各群−2mg8週間隔投与群 ※3 非劣性(非劣性限界値-4文字)の片側検定
階層的検定手順に従い、下位の「8mg投与群併合の中心窩領域にIRFおよびSRFが認められなかった患者の16週目における優越性」は示されたが、続く「8mg12週間隔投与群の最高矯正視力の48週目における優越性」が示されなかったため、検定を終了した。
●
MMRM(mixed model for repeated measurements):反復測定混合効果モデル。ベースラインの最高矯正視力文字数を共変量、投与群、来院および層別因子[地域(日本、その他の地域)、ベースラインの最高矯正視力文字数(60文字未満、60文字以上)]を固定効果とし、ベースラインの最高矯正視力文字数と来院の交互作用項、投与群と来院の交互作用項を含む。
探索的評価項目
96週目における最高矯正視力文字数のベースラインからの変化量は、8mg12週間隔投与群で+5.6文字、8mg16週間隔投与群で+5.5文字、2mg8週間隔投与群で+6.6文字でした
最高矯正視力文字数のベースラインからの変化量(MMRM、FAS)

※ 各群ー2mg8週間隔投与群
●
MMRM:ベースラインの最高矯正視力文字数を共変量、投与群、来院および層別因子[地域(日本、その他の地域)、ベースラインの最高矯正視力文字数(60文字未満、60文字以上)]を固定効果とし、ベースラインの最高矯正視力文字数と来院の交互作用項、投与群と来院の交互作用項を含む。
Focus on Fluid Status
探索的評価項目
96週目におけるCRTのベースラインからの変化量は、8mg12週間隔投与群で-152.0µm、8mg16週間隔投与群で-148.8µm、2mg8週間隔投与群で-146.8µmでした
CRTのベースラインからの変化量(MMRM、FAS)

※ 各群ー2mg8週間隔投与群
●
MMRM:ベースラインのCRTを共変量、投与群、来院および層別因子[地域(日本、その他の地域)、ベースラインの最高矯正視力文字数(60文字未満、60文字以上)]を固定効果とし、ベースラインのCRTと来院の交互作用項、投与群と来院の交互作用項を含む。
Focus on Treatment Burden
探索的評価項目
8mg12週間隔投与群において96週目まで投与間隔が12週間隔以上であった患者の割合は75.3%、8mg16週間隔投与群において96週目まで投与間隔が16週間隔以上であった患者の割合は70.2%でした
8mg12週間隔投与群において96週目まで投与間隔が12週間隔以上であった患者の割合(SAF※1)

8mg16週間隔投与群において96週目まで投与間隔が16週間隔以上であった患者の割合(SAF※1)

96週目までに投与間隔が短縮となった患者の割合、次回予定された投与間隔別の患者の割合(SAF※1)
(事前に規定されたその他の評価項目)

例数(%)
※1 SAFのうち96週目までの投与を完了した患者のみ
※2 52週目以降に16週間隔以上に延長となった患者における12週間隔への短縮は除く
※3 96週目より前の最終来院日における評価に基づく投与間隔(すなわち92週目までの最終来院日における評価に基づく投与間隔)
事後解析
96週目まで20週以上の投与間隔を維持した患者の割合
本事後解析は、電子添文の「17. 臨床成績」における記載に関連し、電子添文改訂の審査過程において評価を受けた解析結果であるため掲載しています。
52週目以降に投与間隔を20週まで延長し、96週目まで20週以上の投与間隔を維持した患者の割合(SAF※1)
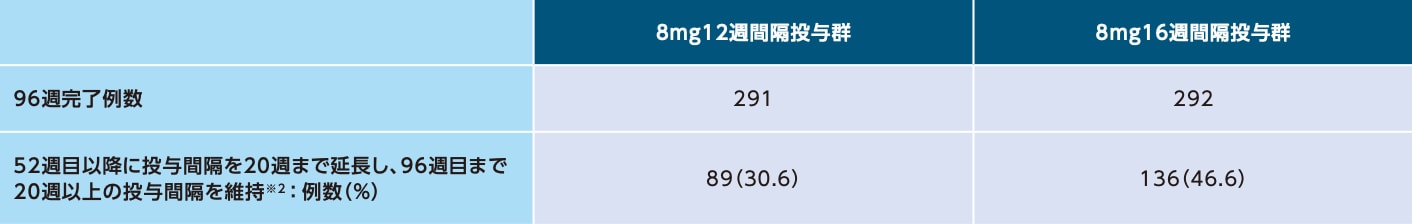
※1 SAFのうち96週目までの投与を完了した患者のみ
※2 96週目に20週の投与間隔をはじめて完了する患者を含まない
【参考】
PULSAR試験におけるアイリーア8mg投与群2群の52週目以降の用法用量の変更
52週目以降、投与来院日にDRM基準を満たした場合、
●DRM基準(短縮):投与間隔を4週幅で短縮した(最短8週間隔)
●DRM基準(延長):投与間隔を4週幅で延長した(最長24週間隔※)
※ 96週目までの期間内に実際の投与の完了が可能であった間隔は最長20週であった
事前に規定された
その他の評価項目
試験眼に対する投与回数は、48週目では8mg12週間隔投与群で5.9回、8mg16週間隔投与群で5.1回、2mg8週間隔投与群で6.7回、96週目ではそれぞれ9.2回、7.8回、11.9回でした
48週目および96週目までの投与回数※1(試験眼、SAF)

※1 偽注射を除く投与回数
※2 SAF(n=338)のうち1例が欠測
Safety
96週間において、すべての有害事象は8mg12週間隔投与群で335例中292例(87.2%)、8mg16週間隔投与群で338例中303例(89.6%)、2mg8週間隔投与群で336例中300例(89.3%)に認められました
有害事象(96週間、SAF)

発現例数(発現割合%)
96週間において、各群の主な有害事象、試験薬に関連する重篤な有害事象、試験薬に関連する投与中止に至った有害事象、試験薬に関連する死亡は以下の通りでした
主な有害事象(96週間、SAF)
8mg12週間隔投与群:
COVID-19 58例(17.3%)、白内障31例(9.3%)、高血圧23例(6.9%)、視力低下21例(6.3%)、網膜出血、上咽頭炎、背部痛が各18例(5.4%)、網膜下液14例(4.2%)、尿路感染13例(3.9%)、眼圧上昇、下痢、関節痛が各12例(3.6%)、上気道感染11例(3.3%)、黄斑肥厚、結膜出血、新生血管加齢黄斑変性が各10例(3.0%) など
8mg16週間隔投与群:
COVID-19 72例(21.3%)、白内障32例(9.5%)、上咽頭炎27例(8.0%)、視力低下、高血圧が各23例(6.8%)、網膜出血19例(5.6%)、硝子体浮遊物17例(5.0%)、尿路感染16例(4.7%)、背部痛15例(4.4%)、咳嗽13例(3.8%)、硝子体剥離12例(3.6%)、黄斑浮腫、眼圧上昇、関節痛が各11例(3.3%)、肺炎、変形性関節症が各10例(3.0%) など
2mg8週間隔投与群:
COVID-19 60例(17.9%)、上咽頭炎30例(8.9%)、視力低下24例(7.1%)、白内障、背部痛が各22例(6.5%)、尿路感染21例(6.3%)、網膜出血19例(5.7%)、高血圧18例(5.4%)、網膜下液、硝子体浮遊物が各16例(4.8%)、転倒13例(3.9%)、上気道感染12例(3.6%)、ドライアイ11例(3.3%)、黄斑浮腫、眼圧上昇、気管支炎、咳嗽、発熱が各10例(3.0%) など
試験薬に関連する重篤な有害事象(96週間、SAF)
8mg12週間隔投与群:本試験においては認められなかった
8mg16週間隔投与群:心筋梗塞2例、閉塞隅角緑内障、肺塞栓症が各1例
2mg8週間隔投与群:脳血管発作2例、急性心筋梗塞、高血圧が各1例
試験薬に関連する投与中止に至った有害事象(96週間、SAF)
8mg12週間隔投与群:本試験においては認められなかった
8mg16週間隔投与群:虹彩毛様体炎、網膜下液が各1例
2mg8週間隔投与群:脳血管発作、ぶどう膜炎、血管炎が各1例
試験薬に関連する死亡(96週間、SAF)
本試験においては認められなかった
MedDRA ver.26.0
まとめ①
nAMD治療では、改善した視力を長期にわたり維持することを目指すことが重要ですが、治療の中断が課題であり、患者の負担とニーズを考慮し、患者と共に持続可能な管理方法を選択することも重要であると考えられます
黄斑疾患治療において、疾患活動性を示す血管新生や血管透過性亢進などの病態を持続してコントロールし、長期的に視力低下を防ぐことが重要であり、SDCとはその治療達成を目指した治療目標です。

nAMDの完治は不可能であり、病状や患者負担を考慮し、患者と共に持続可能な管理方法を選択することが求められています1)。
nAMD患者の治療を中断した割合は治療開始後2年間で26%に及び、治療の中断は治療開始後3年目以降も報告されています(海外データ)2)。
nAMD患者では治療中断後、12ヵ月間で38.2%、24ヵ月間で50.0%に再燃が認められたことが報告されています3)。
nAMDおよびDME患者の治療アドヒアランスの障壁として最も多く報告されたのは時間的負担(通院・待ち時間)であり、特に治療経過の長い患者で多く報告されました(海外データ)4)。
1)日本網膜硝子体学会新生血管型加齢黄斑変性診療ガイドライン作成ワーキンググループ:新生血管型加齢黄斑変性の診療ガイドライン, 日眼会誌. 2024;128:680-698.
2)Spooner K, et al.:Ophthalmol Retina. 2021;5:511-518.
3)Matsubara H, et al.:Graefes Arch Clin Exp Ophthalmol. 2022;260:1867-1876.
4)Müller S, et al.:Int J Retina Vitreous. 2021;7:43.
まとめ②
アイリーア8mgは、既承認のアイリーアと比べ、より高濃度(114.3mg/mL)のアフリベルセプトを含み、より高容量(0.07mL)で硝子体内投与を行う製剤です
nAMD患者において、アイリーア8mg12週間隔投与群および16週間隔投与群の48週目の視力改善効果は、アフリベルセプト2mg8週間隔投与群に対して非劣性であることが検証されました。48週目までの平均投与回数は、アイリーア8mg12週間隔投与群および16週間隔投与群でそれぞれ5.9回、5.1回、アフリベルセプト2mg8週間隔投与群で6.7回でした(第Ⅲ相試験:PULSAR試験)。
48週目における最高矯正視力文字数のベースラインからの変化量(検証的解析結果)
- アイリーア8mg12週間隔投与群+6.1文字 vs アフリベルセプト2mg8週間隔投与群+7.0文字[群間差(両側95%信頼区間):-1.0(-2.9,0.9)]であった(非劣性限界値:-4文字)
- アイリーア8mg16週間隔投与群+5.9文字 vs アフリベルセプト2mg8週間隔投与群+7.0文字[群間差(両側95%信頼区間):-1.1(-3.0,0.7)]であった(非劣性限界値:-4文字)
nAMD患者において、16週目に中心窩領域にIRFおよびSRFが認められなかった患者の割合に関して、アイリーア8mg投与群併合のアフリベルセプト2mg8週間隔投与群に対する優越性が示されました(第Ⅲ相試験:PULSAR試験)。
16週目に中心窩領域にIRFおよびSRFが認められなかった患者の割合は、アイリーア8mg投与群併合で63.3%であり、アフリベルセプト2mg8週間隔投与群(51.6%)に対する優越性が示された(p=0.0002、片側CMH検定)
アイリーア8mg12週間隔投与群および16週間隔投与群では、4週間隔で連続3回投与後、12週間隔および16週間隔で硝子体内投与した(ただし、16週目以降、DRM基準に従い投与間隔を変更した)。アフリベルセプト2mg8週間隔投与群では、4週間隔で連続3回投与後、8週間隔で硝子体 内投与した。
nAMDの維持期において、通常、16週ごとに1回の硝子体内投与が可能です※。
nAMD患者において、アイリーア8mg16週間隔投与群の48週目および60週目まで投与間隔が16週間隔であった患者の割合はそれぞれ76.6%、74.1%でした(第Ⅲ相試験:PULSAR試験)。
※
中心窩下脈絡膜新生血管を伴う加齢黄斑変性の用法及び用量:アフリベルセプト(遺伝子組換え)として8mg(0.07mL)を4週ごとに1回、通常、連続3回(導入期)硝子体内投与するが、症状により投与回数を適宜減じる。その後の維持期においては、通常、16週ごとに1回、硝子体内投与する。なお、症状により投与間隔を適宜調節するが、8週以上あけること。
重大な副作用注)として、眼障害(眼内炎、眼圧上昇、硝子体はく離、外傷性白内障、網膜出血、網膜色素上皮裂孔、硝子体出血、網膜はく離、網膜裂孔、網膜色素上皮はく離)、脳卒中、主な副作用として結膜出血、眼痛などがあらわれることがあります。電子添文の副作用および臨床成績の安全性の結果をご参照ください。
注)投与手技に起因する有害事象を含む。
バイエル薬品社内資料[日本人を含む第Ⅲ相国際共同試験:PULSAR試験]承認時評価資料
PULSAR試験の96週までの成績は以下の通りでした
96週目における最高矯正視力文字数のベースラインからの変化量(最小二乗平均値)は、8mg12週間隔投与群で+5.6文字、8mg16週間隔投与群で+5.5文字、2mg8週間隔投与群で+6.6文字であり、96週目までの平均投与回数はそれぞれ9.2回、7.8回、11.9回でした(第Ⅲ相試験:PULSAR試験)。
96週目に中心窩領域にIRFおよびSRFが認められなかった患者の割合は、8mg12週間隔投与群で69.6%、8mg16週間隔投与群で63.6%、2mg8週間隔投与群で66.5%でした(第Ⅲ相試験:PULSAR試験)。
8mg16週間隔投与群において96週目まで投与間隔が16週間隔以上であった患者の割合は70.2%であり、96週時点で、53.1%で次回予定された投与間隔を20週間隔以上に、30.8%で24週間隔に延長すると判断されていました(第Ⅲ相試験:PULSAR試験)。
96週間において、すべての有害事象は8mg12週間隔投与群で335例中292例(87.2%)、8mg16週間隔投与群で338例中303例(89.6%)、2mg8週間隔投与群で336例中300例(89.3%)に認められました(第Ⅲ相試験:PULSAR試験)。
96週間において、主な有害事象は8mg12週間隔投与群でCOVID-19 58例(17.3%)、白内障31例(9.3%)、8mg16週間隔投与群でCOVID-19 72例(21.3%)、白内障32例(9.5%)、2mg8週間隔投与群でCOVID-19 60例(17.9%)、上咽頭炎30例(8.9%)などでした(第Ⅲ相試験:PULSAR試験)。
バイエル薬品社内資料[日本人を含む第Ⅲ相国際共同試験:PULSAR試験]電子添文改訂時評価資料(96週)



