抗VEGF治療中のnAMDおよびDME患者さんにおける更なる投与間隔延長を目指して

1)Uemura A, et al.: Prog Retin Eye Res. 2021. DOI: 10.1016/j.preteyeres.2021.100954. 利益相反:本論文の編集補助者に対して、Bayer Consumer Care AGより資金提供があった。著者にBayerより研究費、講演料、謝礼などを受領している者が含まれる。
2)Papadopoulos N, et al.: Angiogenesis. 2012; 15(2): 171-185. 利益相反:本論文の著者全員がRegeneronの社員である。
3)Saharinen P, et al.: Nat Rev Drug Discov. 2017; 16(9): 635-661
現在承認されている抗VEGF薬は共通して、主な標的因子としてVEGF-Aの阻害作用を有しています(2025年6月時点)
抗VEGF薬の物質特性一覧

監修:北海道大学 大学院医学研究院 眼科学教室 教授 石田 晋 先生
1)
Uemura A, et al.: Prog Retin Eye Res. 2021. DOI: 10.1016/j.preteyeres.2021.100954. 利益相反:本論文の編集補助者に対して、 Bayer Consumer Care AGより資金提供があった。著者にBayerより研究費、講演料、謝礼などを受領している者が含まれる。
2)
Papadopoulos N, et al.: Angiogenesis. 2012; 15(2): 171-185. 利益相反:本論文の著者全員がRegeneronの社員である。
3)
Carle MV, et al.: Expert Rev Ophthalmol. 2013; 8(3): 227-235. 利益相反:著者にRegeneronよりコンサルタント料などを受領している者が含まれる。
4)
Tadayoni R, et al.: Ophthalmologica. 2021; 244(2): 93-101. 利益相反:著者にBayerより研究費、コンサルタント料などを受領している者が含まれる。
5)
Regula JT, et al.: EMBO Mol Med. 2016; 8(11): 1265-1288.
VEGF-Aに対する結合親和性を示すKD(平衡解離定数)は、アフリベルセプトでは0.1719pM*でした
VEGF-Aに対する結合親和性(in vitro)1)
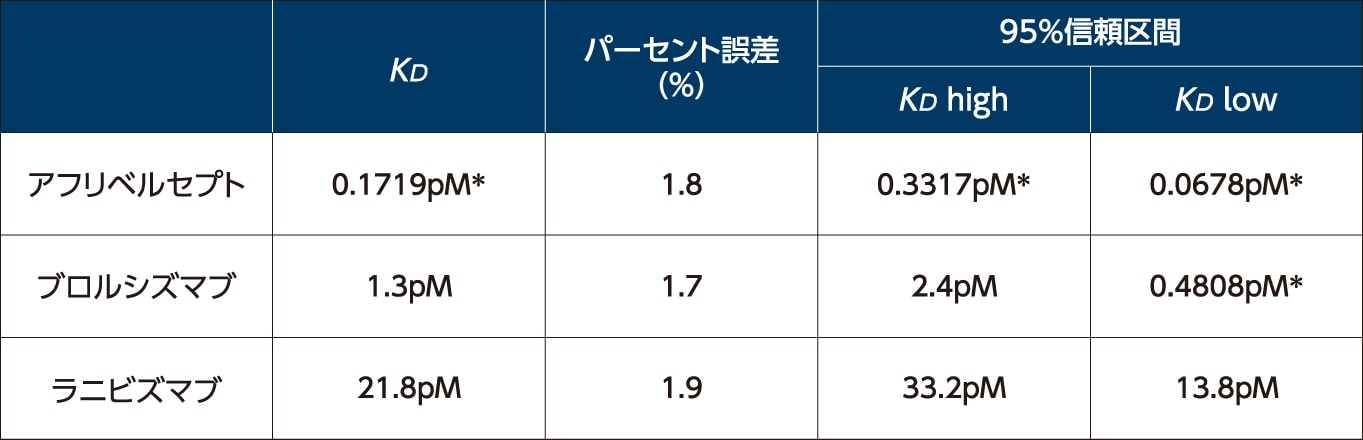
* 原著から単位(fM→pM)を変更
KD(equilibrium dissociation constant):平衡解離定数(結合親和性の強さを示す値、数値が小さいほど結合しているリガンドと受容体の濃度が高いことを示す)
95%信頼区間は理想的なKD曲線に当てはめることにより算出
方法
組換え型ヒトVEGF-A165を用いたアフリベルセプト、ブロルシズマブおよびラニビズマブの結合親和性は結合平衡除外法(Kinetic Exclusion Assay)により検討し、平衡解離定数は非線形回帰分析から求めた。
利益相反
本試験はBayerおよびRegeneronの支援のもと実施、著者らはすべてRegeneronもしくはBayerの社員(元社員を含む)である。
1)Schubert W, et al.: Transl Vis Sci Technol. 2022; 11: 36.より一部改変 https://creativecommons.org/licenses/by/4.0/
VEGF-A阻害作用を示す細胞内カルシウム動員に対するIC50(50%阻害濃度)はアフリベルセプトでは2.42nMでした
VEGF-Aによる細胞内カルシウム動員に対する阻害作用(IC50, in vitro)1)
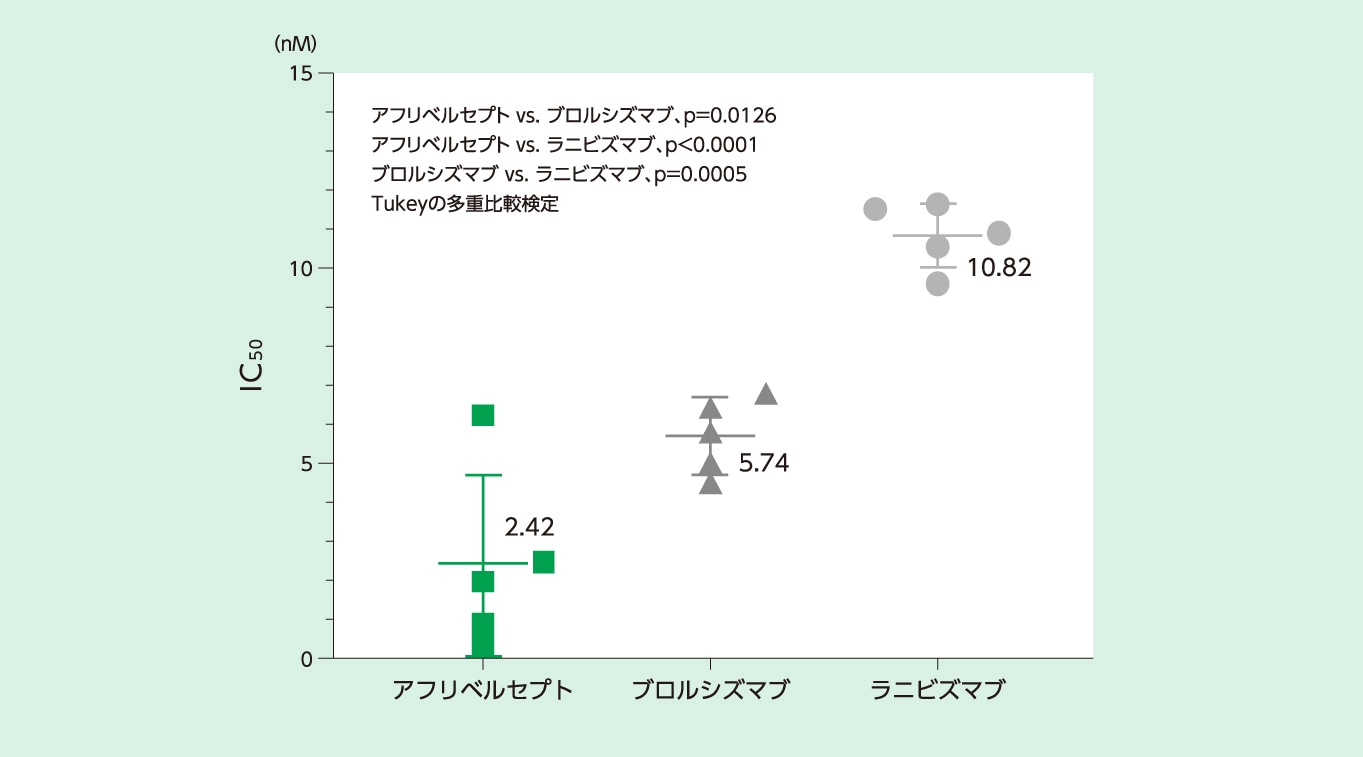
IC50(50%阻害濃度):阻害の強さを示す値。数値が小さいほど低濃度でリガンドと受容体との結合を50%阻害したことを示す
方法
ヒト臍帯静脈内皮細胞(human umbilical vein endothelial cell:HUVEC)を用い、組換え型ヒトVEGF-A165による細胞内カルシウム動員を測定し、アフリベルセプト、ブロルシズマブおよびラニビズマブのヒトVEGF受容体阻害作用を検討した。
利益相反
本試験はBayerおよびRegeneronの支援のもと実施、著者らはすべてRegeneronもしくはBayerの社員(元社員を含む)である。
1)Schubert W, et al.: Transl Vis Sci Technol. 2022; 11: 36.より一部改変 https://creativecommons.org/licenses/by/4.0/
アイリーア高濃度製剤開発の背景・詳細1-3)

アイリーア高濃度製剤開発にあたり実施された試験
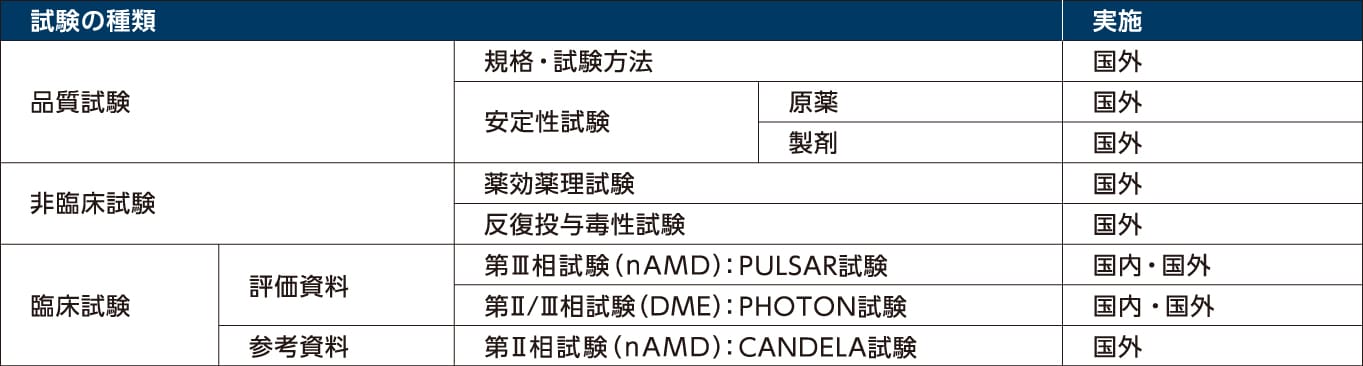
1)バイエル薬品社内資料[海外第Ⅱ相試験:CANDELA試験]承認時参考資料
2)バイエル薬品社内資料[日本人を含む第Ⅲ相国際共同試験:PULSAR試験]承認時評価資料
3)バイエル薬品社内資料[日本人を含む第Ⅱ/Ⅲ相国際共同試験:PHOTON試験]承認時評価資料
アフリベルセプト増量の根拠
<シミュレーション1-3)>
高濃度製剤を用いてより高用量のアフリベルセプトを硝子体内投与したときのシミュレーション(ヒト硝子体内における遊離型アフリベルセプト濃度-時間プロファイルを1-コンパートメントモデルにより推定†)では、アフリベルセプト8mgの硝子体内投与により、既承認のアフリベルセプト2mg硝子体内投与と比較して投与間隔を約20日(2半減期)延長できると予測された
†
照会事項への回答
<反復投与毒性試験4)>
高用量(4および7mg/眼)のアフリベルセプトをサルに反復硝子体内投与した毒性試験では、眼球外に可逆性の病理組織学的な所見(鼻甲介呼吸上皮の病変)が認められたものの、これはアフリベルセプト2mg製剤の開発時に実施したサル毒性試験 (アフリベルセプト0.5~4mg/眼を反復投与)で既に報告されているものであった
1)バイエル薬品社内資料[海外第Ⅱ相試験:CANDELA試験]承認時参考資料
2)バイエル薬品社内資料[日本人を含む第Ⅲ相国際共同試験:PULSAR試験]承認時評価資料
3)バイエル薬品社内資料[日本人を含む第Ⅱ/Ⅲ相国際共同試験:PHOTON試験]承認時評価資料
4)バイエル薬品社内資料[反復投与毒性試験、局所刺激性試験:サル硝子体内投与]アイリーア8mg承認時評価資料
アイリーア高濃度製剤の特徴・臨床試験計画1-3)
アイリーア高濃度製剤の特徴
アイリーア8mg(アフリベルセプト濃度114.3mg/mL)
アフリベルセプト濃度を既承認の40mg/mL(用量2mg)※から114.3mg/mL(用量8mg)へ増加することにより、より多くの有効成分の硝子体内投与を可能とした新たな製剤である
アイリーア8mgの硝子体内投与では、アフリベルセプト2mgと比べ作用持続時間の延長が期待できる
※
未熟児網膜症以外の効能及び効果における用量[未熟児網膜症:40mg/mL(用量0.4mg)]
アイリーア8mgの臨床試験計画
nAMDおよびDME患者を対象に、アイリーア8mgの12週間隔または16週間隔投与が、アフリベルセプト2mgの8週間隔投与と比較して、同様の有効性および安全性を示すかを検討することを目的とし、臨床試験を計画した
1)バイエル薬品社内資料[海外第Ⅱ相試験:CANDELA試験]承認時参考資料
2)バイエル薬品社内資料[日本人を含む第Ⅲ相国際共同試験:PULSAR試験]承認時評価資料
3)バイエル薬品社内資料[日本人を含む第Ⅱ/Ⅲ相国際共同試験:PHOTON試験]承認時評価資料
アイリーア8mgの承認申請における臨床データパッケージ
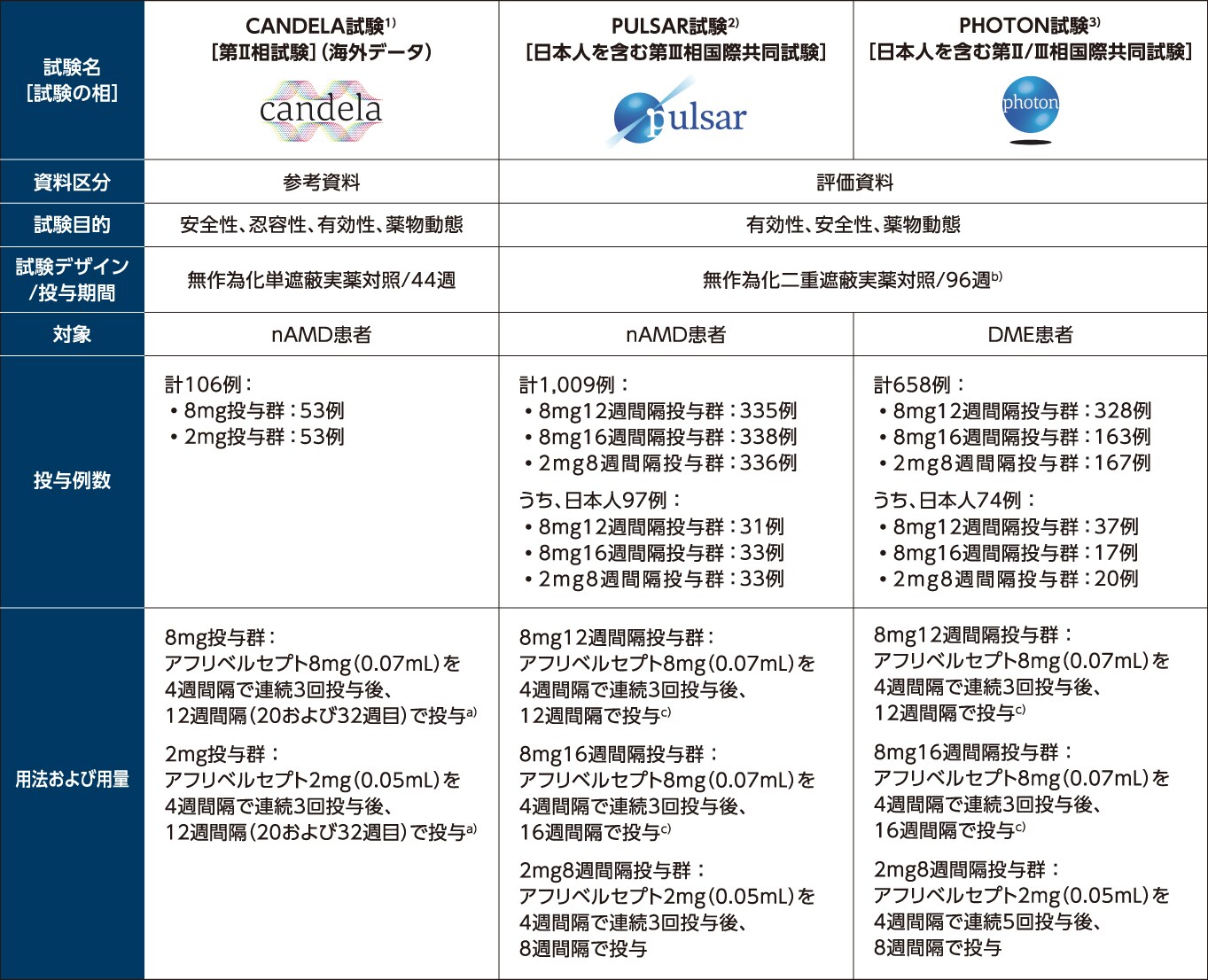
a)事前に規定した基準に従い、24、28、36または40週目に追加投与が可能であった
b)試験は96週目以降、約1年(60週)延長予定
c)事前に規定した基準に従い、16週目以降、投与間隔の変更が可能であった
1)バイエル薬品社内資料[海外第Ⅱ相試験:CANDELA試験]承認時参考資料
2)バイエル薬品社内資料[日本人を含む第Ⅲ相国際共同試験:PULSAR試験]承認時評価資料
3)バイエル薬品社内資料[日本人を含む第Ⅱ/Ⅲ相国際共同試験:PHOTON試験]承認時評価資料
[PPKモデルに基づくシミュレーション]
アフリベルセプト2mg投与8週後の眼内の遊離型アフリベルセプト濃度(中央値)は、アイリーア8mg投与14週後と同程度と推定されました
アフリベルセプト2mgおよびアイリーア8mg単回硝子体内投与後の眼内の遊離型アフリベルセプト曝露量のPPKモデルに基づく予測推移(日本人および外国人データ)1)
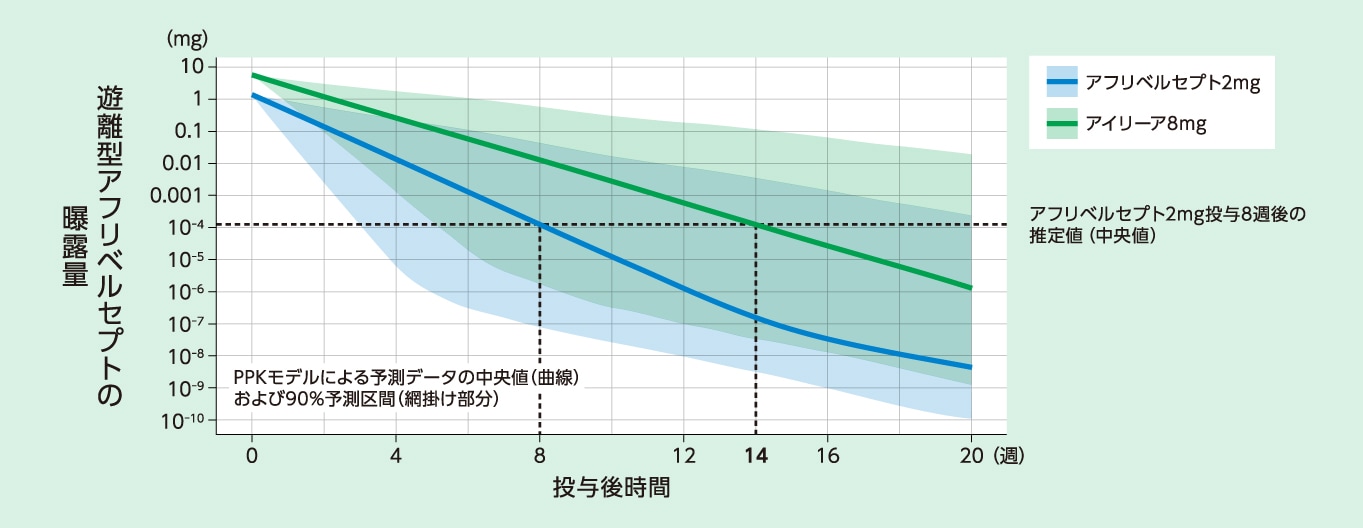
PPKモデル:母集団薬物動態モデル コンパートメントモデル:体内を1つまたは複数の区画(コンパートメント)に分けて単純化したモデル
方法
nAMDおよびDME患者を対象にアイリーア8mgを投与した3試験(CANDELA試験、PULSAR試験、PHOTON試験)に加え、nAMD患者、DME患者、健康成人およびがん患者を対象にアフリベルセプトを投与した13試験の計16試験のデータを用いて、アフリベルセプトのPPKモデル(アフリベルセプトが中心コンパートメントにおいてMichaelis-Menten機構によりVEGFと結合する3-コンパートメントモデル[中心(血漿)および2つの末梢(組織)のコンパートメントにより構成])を構築した。このPPKモデルに基づき、nAMDおよびDME患者の眼にアフリベルセプト2mgおよびアイリーア8mgを単回硝子体内投与したときの遊離型アフリベルセプト曝露量の推移を予測した。
1)バイエル薬品社内資料[薬物動態:母集団薬物動態解析]アイリーア8mg承認時評価資料
アイリーア8mg:中心窩下脈絡膜新生血管を伴う加齢黄斑変性、糖尿病黄斑浮腫の用法及び用量
アフリベルセプト(遺伝子組換え)として8mg(0.07mL)を4週ごとに1回、通常、連続3回(導入期)硝子体内投与するが、症状により投与回数を適宜減じる。その後の維持期においては、通常、16週ごとに1回、硝子体内投与する。なお、症状により投与間隔を適宜調節するが、8週以上あけること。
まとめ
nAMDおよびDMEの病態には、VEGF-Aが主要な役割を担うと考えられており1,2)、 VEGF阻害剤はnAMDおよびDMEに対する標準治療とされています
抗VEGF療法の良好なベネフィット・リスクプロファイルを維持しながら投与間隔を延長する新しい治療法にアンメットニーズがあると考えられていることを背景に、投与間隔の延長が期待される製剤として、アイリーア高濃度製剤が開発されました3-5)
投与間隔を延長することにより投与回数が少なくなれば、
投与手技に関連する有害事象のリスクの軽減 や、
患者、医師、介護者および医療従事者の負担の軽減 が期待できます
アイリーア8mgは、既承認のアイリーア(2mg)に比べ、投与間隔の延長が期待される薬剤です6)
PPKモデルに基づくシミュレーションでは、アフリベルセプト2mg投与8週後の眼内の遊離型アフリベルセプト濃度は、アイリーア8mg投与14週後と同程度と推定されました
本項目では、nAMDは新生血管型AMDを指す
1)
Uemura A, et al.: Prog Retin Eye Res. 2021. DOI: 10.1016/j.prete yeres.2021.100954. 利益相反:本論文の編集補助者に対して、Bayer Consumer Care AGより資金提供があった。著者にBayerより研究費、講演料、謝礼などを受領している者が含まれる。
2)
Papadopoulos N, et al.: Angiogenesis. 2012; 15(2): 171-185. 利益相反:本論文の著者全員がRegeneronの社員である。
3)
バイエル薬品社内資料[海外第Ⅱ相試験:CANDELA試験]承認時参考資料
4)
バイエル薬品社内資料[日本人を含む第Ⅲ相国際共同試験:PULSAR試験]承認時評価資料
5)
バイエル薬品社内資料[日本人を含む第Ⅱ/Ⅲ相国際共同試験:PHOTON試験]承認時評価資料
6)
バイエル薬品社内資料[薬物動態:母集団薬物動態解析]アイリーア8mg承認時評価資料



