Sustainable Disease Control in DME
~持続可能なDME治療を目指して~
黄斑疾患治療において、疾患活動性を示す血管新生や血管透過性亢進などの病態を持続してコントロールし、長期的に視力低下を防ぐことが重要であり、Sustainable Disease Control(SDC)とはその達成を目指した治療目標である。
滲出型加齢黄斑変性(nAMD)と糖尿病黄斑浮腫(DME)におけるSDC達成に向けた課題と治療選択について専門医に伺った。

吉田 茂生 先生
久留米大学 医学部
眼科学講座
Sustainable Disease Control(SDC)
黄斑疾患治療において、疾患活動性を示す血管新生や血管透過性亢進などの病態を持続してコントロールし、長期的に視力低下を防ぐことが重要であり、SDCとはその治療達成を目指した指標

監修:鹿児島大学大学院 医歯学総合研究科 先進医療科学専攻 感覚器病学講座 眼科学分野 教授 坂本 泰二先生
1)
Bhagat D, et al.: Clin Ophthalmol. 2020; 14: 2975-2982
2)
Joko T, et al.: Patient Prefer Adherence. 2020; 14: 553-567
3)
Ohji M, et al.: Adv Ther. 2020; 37: 1173-1187
4)
Do DV, et al.: Ophthalmology. 2011; 118: 1819-1826
5)
Dugel PU, et al.: Ophthalmology. 2020; 127: 72-84
6)
Heier JS, et al.: Lancet. 2022; 399: 729-740
7)
Brown DM, et al.: Am J Ophthalmol. 2022; 238: 157-172
8)
Wykoff CC, et al.: Lancet. 2022; 399: 741-755
糖尿病黄斑浮腫(DME)治療における課題
DME治療には、レーザー光凝固、硝子体手術、薬物療法としてのステロイド局所投与、抗血管内皮細胞増殖因子(VEGF)薬があり、それぞれに長所と短所がある。光凝固は比較的確立した治療である一方、Atrophic creepが問題となる。ステロイドは安価であるが、白内障の進行や緑内障といった局所の合併症が問題となる。硝子体手術は薬物療法が無効な難治例にも適用可能である一方、効果にばらつきがあるといわれている。現在、DME治療の中心である抗VEGF薬は、DMEコントロールが不良な患者や中心窩に及ぶ病態に対しても投与が可能などの長所がある一方で、高価であり、全身性の合併症など注意が必要である。
また、DME治療に影響する要因として、患者側の課題(視力、通院頻度、居住地、経済状況、全身状態、アドヒアランスなど)と医療者側の課題(複雑な病態、難治例、個別化医療、働き方改革など)が存在すると考えている(表1)。こういったことを勘案しながら、各治療法の特徴を上手く組み合わせて、個別化医療を展開することが大切である。
表1 DME治療に影響する要因

吉田茂生先生ご提供
Sustainable Disease Control(SDC)達成に求められる基準
DME治療において、疾患活動性を示す血管新生や血管透過性亢進などを持続的にコントロールし、長期的な視力低下を予防することが重要である。この治療目標はSDCと呼ばれ、達成には次に挙げる3つの基準が求められている。それぞれの基準における現状と課題を述べる。
① 改善した視力を長期に維持できる
抗VEGF薬のDMEに対する有用性は多数の大規模臨床試験で示されてきた。VISTA-DME試験では、5年にわたる長期成績が報告されている1,2)。VISTA-DME試験の148週目における最高矯正視力文字数(BCVA)のベースラインからの平均変化量は、アイリーア(2mg)4週ごと投与群で+10.4文字、8週ごと投与群で+10.5文字であった。更にVISTA-DME試験の完了症例60例を対象に実施されたENDURANCE延長試験2)において、ENDURANCE試験開始時から104週時点のBCVAの平均変化量は+0.8文字であった。
また、高村らが報告した後ろ向き研究3)において、浮腫の再発から抗VEGF薬投与までの待機期間(WT)が短いほど、視力予後が良好であったことから(図1)、早期からの積極的な治療介入が視力改善に寄与すると考えられる。
抗VEGF療法は、患者により反応性が異なることから治療継続についての判断が課題となる中、長期視力予後を予測できる可能性について報告されている。抗VEGF薬の硝子体内投与を受けた、中心窩に及ぶDMEを有する20例25眼を対象とした後ろ向き研究4)によると、ベースライン時から導入期として3回毎月投与が終了した3ヵ月時点までのBCVAの変化量と、ベースライン時から12ヵ月時点までのBCVAの変化量の間には正の相関がみられた(r=0.60、名目上のp<0.005;ピアソンの相関係数)(図2)。導入期に積極的な治療を行うことで、継続して抗VEGF薬投与が必要か判断する有用な情報になると考えられる。この反応性も参考に、患者個人の病態に合わせて患者にとって最良の治療方法を選択し、できるだけ早期から十分な治療を実施することが重要である。
図1 初回投与までの期間別に検討したBCVAの変化

Takamura Y, et al.: J Clin Med 2021; 10(24): 5738
利益相反:本論文の著者にBayerより謝礼および研究費を受領した者が含まれる。
図2 ΔBCVAM3とΔBCVAM12におけるピアソンの相関係数

Koyanagi Y, et al.: Ophthalmologica. 2018; 239: 94-102
利益相反:本論文の著者にBayerより謝礼および研究費を受領した者が含まれる。
② Fluidを速やかに減少させ長期に維持できる
Fluidの存在が視力に影響することが報告されるようになり、ラニビズマブ、アフリベルセプト以降に発売となったブロルシズマブ、ファリシマブの第Ⅲ相臨床試験5,6)を中心に、治療後の網膜厚の変化だけではなく、IRF(網膜内液)、SRF(網膜下液)の有無別の患者の割合も評価項目として検討されるようになってきた。実臨床研究でもそのような傾向にある。フランスで行われた未治療または既治療DME患者を対象としたアイリーア(2mg)の治療成績(APOLLON試験)7)でもfluidに対する評価がされており、SRFを認めた割合は、ベースライン時に未治療群31.3%、既治療群23.3%であったが、治療開始24ヵ月後には、未治療群7.0%、既治療群5.4%であった。また、IRFを認めた割合は、ベースライン時にいずれの治療群も95%を超えていたが、24ヵ月後では未治療群68.4%、既治療群では69.1%であったことが報告された。Fluidに関する評価への関心が高まっている。
我々は近年の臨床的なエビデンスを考慮してDME治療のフローチャート(図3)を提案したが、fluidの原因となり得る毛細血管瘤(MA)の有無がDME治療に大きく関与している。実際に、中心窩網膜厚とMA数が相関することが報告されており8)、MAの効果的な抑制はfluidの早期退縮につながる可能性がある。
このMAに対し抗VEGF薬投与がMA数の減少に寄与することが報告されている9)。さらに、我々の研究においてMAの中でも難治性とされる150μm以上の毛細血管異常のTelangiectatic Capillaries(TelCaps)の数を減少させ、サイズも縮小することを報告している10)(参考情報)。DME治療において抗VEGF薬は多くの場合第一選択となっているが、fluidの原因となり得るMAなどに着目しつつ、レーザーを効果的に併用しながら治療選択することが大切であると考える。
図3 DMEに対する治療のフローチャート

Yoshida S, et al.: Graefes Arch Clin Exp Ophthalmol. 2021; 259: 815-836
③ 負担軽減により治療継続できる
実臨床における抗VEGF薬治療は経済的な負担が大きく、また検査と注射のための頻回な来院も大きな負担となる。そのため、投与間隔の延長が現在の抗VEGF療法のニーズとして求められており、ファリシマブの第Ⅲ相臨床試験(YOSEMITE/RHINE)9)やブロルシズマブの第Ⅲ相臨床試験(KITE)10)では、維持期における最長投与間隔が16週間に設定され、視力結果の最適化と治療負担の軽減を目標に、より長い投与間隔での検討が行われている。
また、レーザー光凝固を併用したアイリーア(2mg)T&E投与の治療成績を評価した多施設共同前向き研究11)では、2年目終了時点で投与間隔が16週間であった割合は66.7%であり、12週間以上であった割合は70%以上であった。この結果から、長期継続投与にはT&Eレジメンを用いることで投与間隔の延長も可能だと考えている。
抗VEGF薬の投与間隔が延長されることにより、医療者側、患者側双方にとって負担軽減のメリットが得られる。一方で、抗VEGF薬投与により、眼内炎や眼圧上昇などの眼局所の合併症には常に注意を払う必要がある。また、一部全身血流に移行してVEGF阻害に起因する動脈血栓塞栓に関連する血管死,心筋梗塞,脳卒中などの全身性の副作用が発現する可能性があることから全身性の安全性への配慮も必要である。このため、DME治療では、原疾患である糖尿病の病態管理も含め内科などの専門医と眼科が密に連携し、患者の状況を常に把握し、適切な治療を目指すことが重要である。
まとめ
DME治療において抗VEGF薬は標準治療になりつつあるが、患者側には身体的・社会的背景、医師側には病態の複雑さに伴う診療負荷など、両者において課題が存在する。現状よりもさらに効果的、効率的な治療の実践が求められている。
DMEに対しては、早期から積極的な治療を行いつつ、患者の視機能を長期に維持することが大切である。そういった観点からも、患者負担軽減のため、投与間隔の延長は抗VEGF薬治療のニーズとなっている。また、内科との連携により常に安全性に注意を払うことも重要である。
文献
1)
Heier JS, et al.: Ophthalmology. 2016; 123: 2376-2385
2)
Wykoff CC, et al.: Br J Ophthalmol. 2018; 102: 631-636
3)
Takamura Y, et al.: J Clin Med 2021; 10(24): 5738
4)
Koyanagi Y, et al.: Ophthalmologica. 2018; 239: 94-102
5)
Wykoff CC, et al.: Lancet. 2022; 399(10326): 741-755
6)
Brown DM, et al.: Am J Ophthalmol. 2022; 238: 157-172
7)
Korobelnik JF, et al.: Sci Rep . 2022; 12(1): 18242.
8)
Sugimoto M et al.: Ophthalmol Retina. 2019; 3(12): 1067-1075
9)
Mori K, et al.: Graefes Arch Clin Exp Ophthalmol. 2020 ; 258(4): 735-741
10)
Itou J, et al.: Clin Ophthalmol. 2023: 17: 239-245
11)
Hirano T, et al.: Sci Rep. 2021; 11: 4488
ALTAIR試験(国内第Ⅳ相試験)
試験概要
目的
PCV患者における、アイリーア単独療法の有効性および安全性を、アイリーア+光線力学的療法(レスキューPDT)と比較検討する。
試験デザイン
96週間、二重遮蔽、偽治療対照、無作為化、第Ⅲb/Ⅳ相試験
試験対象
以下に該当する患者333例(うち、日本人は159例)
- PCVと診断された50歳以上の患者
- 病変最大径(GLD)が5,400μm未満であるか9乳頭面積(DA)未満の患者
- 最高矯正視力(BCVA)がETDRSで73~24文字の患者
投与方法
- 本試験は以下の期間により構成される。
導入期:0~8週目
無作為割り付け:12週目
治療継続期:12~52週目(アイリーア2q8±レスキュー治療)、52~96週目(Treat & Extend※±レスキュー治療) - 導入期にはすべての患者にアイリーアの毎月投与を3回行う。
- 12週目にアイリーア単独療法群、PDT併用療法群のいずれかに1:1の割合で無作為に割り付ける。その際、12週時点でレスキュー治療が必要と評価された患者、および日本人患者が均等に含まれるように割り付ける。(12週時点でレスキュー治療が必要となる患者が各群50名程度であると想定)
- レスキュー治療が不要と評価された患者には52週目までアイリーアを8週ごとに投与する。
- 12週目以降、レスキュー治療が必要と評価された患者には、アイリーア単独療法群ではアイリーアの4週ごと投与とシャムPDTによるレスキュー治療を、PDT併用療法群ではアイリーア4週ごと投与と実薬PDTによるレスキュー治療を行う。
評価項目
<主要評価項目>
- 52週時におけるBCVAのベースラインからの変化量
<副次評価項目>
- 52週時におけるベースラインから15文字以上の視力低下がみられなかった患者の割合
<探索的評価項目>
- 96週時におけるBCVAのベースラインからの変化量
- 96週時におけるベースラインから15文字以上の視力低下がみられなかった患者の割合
- 52週時および96週時における中心サブフィールド網膜厚(CST)のベースラインからの変化量
- 52週時および96週時におけるポリープ状病巣の完全退縮率
- アイリーアおよびPDTによる治療回数
- レスキュー治療を必要とした患者の割合 など
<安全性評価項目>
- すべての有害事象、TEAE、重篤な有害事象、APTC定義に基づく動脈血栓塞栓事象、死亡 など
<事前に規定された評価項目(部分集団解析)>
- レスキュー治療の有無別でみたBCVAのベースラインからの変化量
- 日本人集団における上記のすべての有効性評価項目、および安全性評価項目 など
解析計画
<検証的な解析>
- 主要評価項目(FAS):アイリーア単独療法のPDT併用療法に対する非劣性の検証。変化量の最小二乗平均の群間差(アイリーア単独療法群-PDT併用療法群)の両側95%信頼区間を、ベースライン値を共変量とし、投与群、民族、および12週目におけるレスキュー治療の有無を固定効果とした共分散分析により求める。(非劣性限界値:ETDRS-5文字)
- 副次評価項目(FAS):アイリーア単独療法のPDT併用療法に対する非劣性の検証。主要評価項目の検証により非劣性が認められた場合に、ベースラインからETDRS15文字以上の視力低下がみられなかった患者の割合を確認し、群間差の95%信頼区間を人種/民族および12週目におけるレスキュー治療の有無により調整されたCochran-Mantel-Haenszelにより求める。(非劣性限界値:-7%)
<探索的な解析>
- 探索的評価項目(FAS)、安全性評価項目(SAF)、部分集団解析(FAS)
- 参考として、52週時および96週時における活動性のあるポリープが認められない患者の割合(SAF)を算出する。なお、欠損値の代入にはLOCFを用いる。
利益相反
本試験および本論文の執筆・編集はBayer AG, Berlinの資金提供により行われた。
著者のうち2名はBayerの社員であり、その他の著者にBayerおよび参天製薬より助成金、個人的報酬を受領している者が含まれる。
※治験担当医の裁量により、1週または2週単位で投与間隔を延長する任意Treat & Extend
ETDRS:Early Treatment Diabetic Retinopathy Study
FAS(Full Analysis Set):最大の解析対象集団
SAF(Safety Analysis Set):安全性解析対象集団
TEAE(Treatment-Emergent Adverse Event):治療下で発現した有害事象
APTC:Antiplatelet Trialists’ Collaboration
LOCF(Last Observation Carried Forward):最終評価スコア外挿法
試験デザイン

a:レスキュー基準の評価 b:ベルテポルフィン6mg/m2静注
PDT(実薬またはシャム)はレスキュー基準に該当する場合にのみ、各国の添付文書にそって施行
Lee WK, et al.: JAMA Ophthalmol. 2018; 136: 786-793. Copyright © 2018 American Medical Association. All rights reserved.
レスキュー治療基準

Lee WK, et al.: JAMA Ophthalmol. 2018; 136: 786-793. Copyright © 2018 American Medical Association. All rights reserved.
96週における最高矯正視力文字数のベースラインからの変化量は、日本人集団のアイリーア単独療法群で+9.7文字、PDT併用療法群で+9.5文字でした
主要評価項目(52週、全集団)の結果
アイリーア単独療法群のPDT併用療法群に対する非劣性が検証されました
- ※:
- ベースライン値を共変量とし、投与群、民族、および12週目におけるレスキュー治療の有無を固定効果とした共分散分析。(52週時における非劣性限界値: ETDRS-5文字)
最高矯正視力文字数のベースラインからの変化量の推移
FAS(LOCF)

Lee WK, et al.: JAMA Ophthalmol. 2018; 136: 786-793.
Ogura Y, et al.: Jpn J Ophthalmol. 2021; 65: 344-353.
日本人集団における96週間を通じてレスキュー治療を必要とした患者の割合は、アイリーア単独療法群で18.7%、PDT併用療法群で15.6%でした
レスキュー治療を必要とした患者の割合(96週:日本人集団)<有効性評価項目>
FAS

Ogura Y, et al.: Jpn J Ophthalmol. 2021; 65: 344-353.より作図
日本人集団において、すべてのTEAEはアイリーア単独療法群75例中58例(77.3%)、PDT併用療法群77例中54例(70.1%)に認められました
安全性(96週:日本人集団)<安全性評価項目>
SAF
すべてのTEAEは、アイリーア単独療法群75例中58例(77.3%)、PDT併用療法群77例中54例(70.1%)、無作為化されなかった治療症例*7例中2例(28.6%)に認められました。

アイリーア投与(手技を含む)に関連する有害事象
- ※1:
- 不整脈 1例、上部消化管出血 1例、冠状動脈狭窄症・白内障 1例(2件)
- ※2:
- 網膜動脈分枝閉塞症(BRAO)1例
- ※4:
- 心臓突然死 1例
- ※5:
- RPE tear 1例
- ※6:
- 不整脈 1例
ベルテポルフィン投与(手技を含む)に関連する有害事象
- ※3:
- 視力低下 1例
(PLANET試験 社内資料)
*:治療を受けたが、プロトコルの逸脱、有害事象、脱落、死亡、または追跡不能により12週目に無作為化されなかったすべての患者
Ogura Y, et al.: Jpn J Ophthalmol. 2021; 65: 344-353.
最も多く認められた眼に関連するTEAEは、アイリーア単独療法群で結膜出血8例(10.7%)、PDT併用療法群でドライアイ5例(6.5%)でした
すべての有害事象、TEAE(96週:日本人集団)<安全性評価項目>
SAF

- *:
- 治療を受けたが、プロトコルの逸脱、有害事象、脱落、死亡、または追跡不能により12週目に無作為化されなかったすべての患者
眼に関連する重篤な有害事象は、アイリーア単独療法群で2例(2.7%)、PDT併用療法群で3例(3.9%)に認められました
すべての重篤な有害事象、APTC定義に基づく動脈血栓塞栓事象、死亡(96週:日本人集団)
<安全性評価項目>
SAF
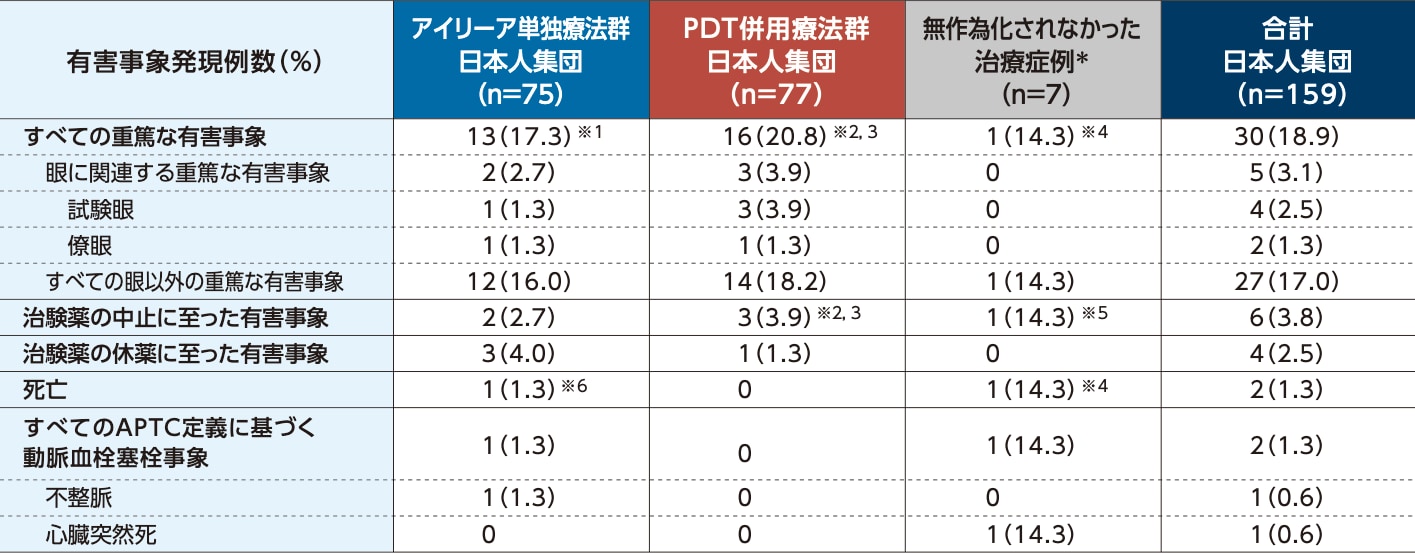
- *:
- 治療を受けたが、プロトコルの逸脱、有害事象、脱落、死亡、または追跡不能により12週目に無作為化されなかったすべての患者
アイリーア投与(手技を含む)に関連する有害事象
- ※1:
- 不整脈 1例、上部消化管出血 1例、冠状動脈狭窄症・白内障 1例(2件);
- ※2:
- 網膜動脈分枝閉塞症(BRAO)1例;
- ※4:
- 心臓突然死 1例;
- ※5:
- RPE tear 1例;
- ※6:
- 不整脈 1例
ベルテポルフィン投与(手技を含む)に関連する有害事象
- ※3:
- 視力低下 1例
(PLANET試験 社内資料)
Ogura Y, et al.: Jpn J Ophthalmol. 2021; 65: 344-353.



