第Ⅲ相試験:VISTA-DME試験(海外データ)1-2)
(レーザー治療に対する優越性の検証)
1)バイエル薬品社内資料[海外第Ⅲ相試験:VISTA-DME試験(外国人)]承認時評価資料
2)バイエル薬品社内資料[日本人を含む第Ⅲ相国際共同試験:VIVID-DME試験]承認時評価資料
本ページでは「アイリーア(2mg)」を「アイリーア」と記載しています。
糖尿病黄斑浮腫(DME)を有する患者を対象とした海外第Ⅱ相試験(DA VINCI試験)の結果から、アイリーアの用法及び用量を「2mgを4週ごとに硝子体内投与する群」および「2mgを4週ごと5回投与後、以降8週ごとに硝子体内投与する群」の2群に設定し、アイリーアのレーザー治療に対する優越性を検証しました。
【実施地域】
米国、54施設
試験概要
目的
中心窩に及ぶDMEを有する患者を対象に、アイリーアの有効性について黄斑レーザー光凝固術に対する優越性を検証するとともに、安全性および忍容性についても検討する
試験対象
DMEを有する患者:466例
[主な選択基準]
1型あるいは2型糖尿病を有する18歳以上の男女かつ
- 試験眼に、黄斑の中心窩(OCTで測定される黄斑の中心部領域)に及ぶDMEを有する
- 試験眼にDMEが原因の視力低下を有する
- スクリーニング時における試験眼のETDRS視力表による最高矯正視力文字数が73~24文字(スネレン視力で20/40~20/320) など
[主な除外基準]
- 試験眼に網膜硝子体手術による治療歴を有する
- 試験眼に初回投与日の前90日以内に、汎網膜光凝固術または黄斑レーザー光凝固術による治療歴を有する
- レーザー治療による効果が期待できないと試験担当医師が判断
- 試験眼に初回投与日の前120日以内に、眼内または眼周囲に副腎皮質ステロイド剤による治療歴を有する
- 試験眼に初回投与日の前90日以内に、VEGF阻害剤による治療歴を有する
- 試験眼に活動性のPDRを有する
- コントロール不良の糖尿病を有する(試験担当医師の判断)
- コントロール不良の高血圧(座位での収縮期血圧160mmHg超、または拡張期血圧95mmHg超)を有する
- 初回投与日の前180日以内に、脳血管障害または心筋梗塞の既往を有する
- 透析または腎移植を必要とする腎不全を有する など
試験デザイン
無作為化二重遮蔽比較対照試験
投与方法
対象患者を、アイリーア投与群(4週ごと投与群、8週ごと投与群)※およびレーザー治療群の3群に無作為に割り付けた。アイリーア4週ごと投与群ではアイリーア2mgを4週ごとに投与した。アイリーア8週ごと投与群では、アイリーア2mgを4週ごとに5回投与した後、24週目以降は8週ごとに投与した。レーザー治療群では黄斑レーザー光凝固術による治療をベースライン時に1回行い、12週目以降はレーザー再治療基準に従い再治療を12週間に1回を超えない頻度で必要に応じて実施した(4週ごとに偽注射も実施)。

※アイリーア投与群は初回投与日にレーザー偽照射を実施し、12週目以降にレーザー再治療基準を満たす場合はレーザー偽照射を実施した。
1) 100週目以降、レーザー治療に加え、アイリーア再投与基準に従い、必要に応じてアイリーア2mgを投与
2) 24週目以降、追加治療基準に従い、必要に応じてレーザー治療群にはアイリーア2mg投与(4週ごと5回投与後、以降8週ごとに投与)、アイリーア投与群にはレーザー治療を実施
[レーザー再治療基準]:12週目以降
レーザー再治療が患者にとって有用であると遮蔽医師が判断し、かつ少なくとも以下のいずれか1つに該当する場合:
- 黄斑中心窩の網膜肥厚が500µm以内
- 黄斑中心窩の硬性白斑が500µm以内(隣接した網膜肥厚と関連する場合)
- 網膜肥厚の範囲が1視神経乳頭以上で、いずれの肥厚も黄斑中心窩の1視神経乳頭の直径以内
レーザー再治療が患者にとって有用でないと遮蔽医師が判断した場合は実施しない。
[追加治療基準]:24週目以降
追加治療の必要性(遮蔽医師による評価)
24週目以降、遮蔽医師は、以下の条件のいずれかまたは両方が満たされる場合は、追加治療を考慮することとした。
- 最高矯正視力文字数が前回までの最高値と比べて15文字以上低下し、かつベースラインよりも低下
- 最高矯正視力文字数が前回までの最高値と比べて続けて10文字以上低下し、かつベースラインよりも低下(来院間隔は7日以上で、規定外来院の場合も含む)
追加治療の実施(非遮蔽医師)
- アイリーア投与群:レーザー再治療基準に従い、黄斑レーザー光凝固術を実施(ただし、偽照射は行わない)
- レーザー治療群:アイリーア2mgを8週ごと投与群と同様に、まず4週ごとにアイリーアを5回投与し、その後4週ごとにアイリーアの投与と偽注射を交互に(それぞれ8週ごとに)実施
追加治療を受ける患者は、遮蔽性を保つために最終来院まで割り付けられた用法及び用量に基づいた治療および遮蔽下での検査を継続することとした。
[アイリーア再投与基準]:100週目以降
- OCTで中心網膜厚(CRT)がそれまでの最低値よりも50µm超増加
- OCTにより検出される新規または持続性の網膜の嚢胞様変化または網膜下液、もしくは中心窩網膜における持続性びまん性浮腫
- OCTによる中心網膜厚(CRT)の増加と併せ、最高矯正視力文字数が既存の最高値から5文字以上低下した場合
- 来院時の最高矯正視力文字数が、前回来院時より5文字以上改善
主な有効性評価項目
主要評価項目:
- 52週目における最高矯正視力文字数のベースラインからの変化量
副次評価項目:
- ① 52週目にベースラインから10文字以上の視力改善がみられた患者の割合
- ② 52週目にベースラインから15文字以上の視力改善がみられた患者の割合
- ③ 52週目におけるETDRS糖尿病網膜症の重症度スコアが2段階以上低下した患者の割合
- ④ 52週目における中心網膜厚(CRT)のベースラインからの変化量
- ⑤ 52週目におけるNEI VFQ-25「近見視力による行動」サブスケールスコアのベースラインからの変化量
- ⑥ 52週目におけるNEI VFQ-25「遠見視力による行動」サブスケールスコアのベースラインからの変化量
追加評価項目:
- 100週目における最高矯正視力文字数のベースラインからの変化量
- 100週目にベースラインから10文字以上の視力改善がみられた患者の割合
- 100週目にベースラインから15文字以上の視力改善がみられた患者の割合
- 100週目におけるETDRS糖尿病網膜症の重症度スコアが2段階以上低下した患者の割合
- 100週目における中心網膜厚(CRT)のベースラインからの変化量
- 100週目におけるNEI VFQ-25の「近見視力による行動」サブスケールスコアのベースラインからの変化量
- 100週目におけるNEI VFQ-25の「遠見視力による行動」サブスケールスコアのベースラインからの変化量
主な安全性評価項目
有害事象、副作用、重篤な有害事象、投与中止に至った有害事象、死亡、APTC定義による動脈血栓塞栓事象 など
解析計画
検証的な解析(第1種の過誤を考慮し、検出力を考慮し例数設計された解析)
- 主要評価項目(FAS):アイリーア投与群のレーザー治療群に対する優越性の検証(両側有意水準2.5%)
第1種の過誤を考慮した解析(検出力を考慮した例数設計はされていない)
- 副次評価項目(FAS):同上。ただし、検定の多重性を考慮し、主要評価項目で優越性が検証された場合に限り、事前に定めた順序(①から昇順)に従い検定を行う。
⑥において優越性が示されなかった。
探索的な解析
- 追加評価項目(FAS)
部分集団解析:VIVID-DME試験における日本人の部分集団解析 など
OCT(optical coherence tomography):光干渉断層計
PDR(proliferative diabetic retinopathy):増殖糖尿病網膜症
FAS(full analysis set):最大の解析対象集団
NEI VFQ-25(National Eye Institute 25-item Visual Function Questionnaire):米国国立眼病研究所の25項目からなる視覚機能についてのアンケート
- 偽注射:硝子体内注射と同じ処置を行うが、注射の代わりに針のない注射シリンジを局所麻酔下で眼球に押し付ける方法
- レーザー偽照射:黄斑治療用のレンズを装着し、細隙灯顕微鏡のスイッチを入れ、レーザー治療群と同じ治療時間、レーザーのスイッチを切ったまま(PASCALレーザーの場合は出力を0)、レーザー照射と同じ音を出す方法
- 中心網膜厚(CRT:central retinal thickness):中心サブフィールド(中心窩から直径1mmの範囲)の網膜厚
糖尿病黄斑浮腫の用法及び用量
アフリベルセプト(遺伝子組換え)として2mg(0.05mL)を1ヵ月ごとに1回、連続5回硝子体内投与する。その後は、通常、2ヵ月ごとに1回、硝子体内投与する。なお、症状により投与間隔を適宜調節するが、1ヵ月以上あけること。
試験対象例数と各群の患者の内訳

- 1)
- 100週目以降、レーザー治療に加え、アイリーア再投与基準に従い、必要に応じてアイリーア2mgを投与
- 2)
- 24週目以降、追加治療基準に従い、必要に応じてレーザー治療群にはアイリーア2mg投与(4週ごと5回投与、以降8週ごとに投与)、アイリーア投与群にはレーザー治療を実施
患者背景および特性(FAS)
VISTA-DME試験において、各群のベースライン時の人口統計学的特性は以下の通りでした。

平均値±標準偏差(性別、人種、重症度スコア、糖尿病コントロール以外)
*スコア値90はグレード不可に分類
レーザー治療/投与回数および追加治療回数
VISTA-DME試験において、52週目までのアイリーア投与群の平均投与回数は、4週ごと投与群で11.8回、8週ごと投与群で8.4回でした。100週目までのアイリーア投与群の平均投与回数は、4週ごと投与群で21.3回、8週ごと投与群で13.5回でした。
レーザー平均治療回数およびアイリーアの平均投与回数(SAF)

平均値±標準偏差(例数)
VISTA-DME試験において、24週目以降、追加治療基準を満たした場合は、追加治療としてレーザー治療群ではアイリーア投与を、アイリーア投与群ではレーザー治療を行うことができました。52週目までに追加治療を行った患者の割合は、アイリーア4週ごと投与群で2.6%、8週ごと投与群で0.7%であり、レーザー治療群では31.2%でした。100週目までの結果においてもアイリーア4週ごと投与群3.2%、8週ごと投与群8.6%、レーザー治療群40.9%の患者割合で追加治療が実施されました。
追加治療の平均回数(SAF)

平均値±標準偏差
視力評価
(1)視力の変化
52週目における最高矯正視力文字数のベースラインからの変化量は、アイリーア4週ごと投与群で+12.5文字、8週ごと投与群で+10.7文字であり、レーザー治療群(+0.2文字)に対するアイリーア投与群の優越性が検証されました。100週目における最高矯正視力文字数のベースラインからの変化量は、アイリーア4週ごと投与群で+11.5文字、8週ごと投与群で+11.1文字であり、レーザー治療群では+0.9文字でした。
最高矯正視力文字数の変化量の推移(LOCF、FAS)

- a)
- 治療群および心筋梗塞または脳血管障害の既往歴を固定効果、最高矯正視力文字数のベースライン値を共変量としたANCOVAモデル
- b)
- 各アイリーア投与群-レーザー治療群
最終評価スコア外挿法(LOCF:Last Observation Carried Forward):欠測値は欠測前の最後の測定値を用いて補完した。なお、追加治療を受けた患者では、追加治療を受ける直前の測定値により補完した。
(2)視力の改善
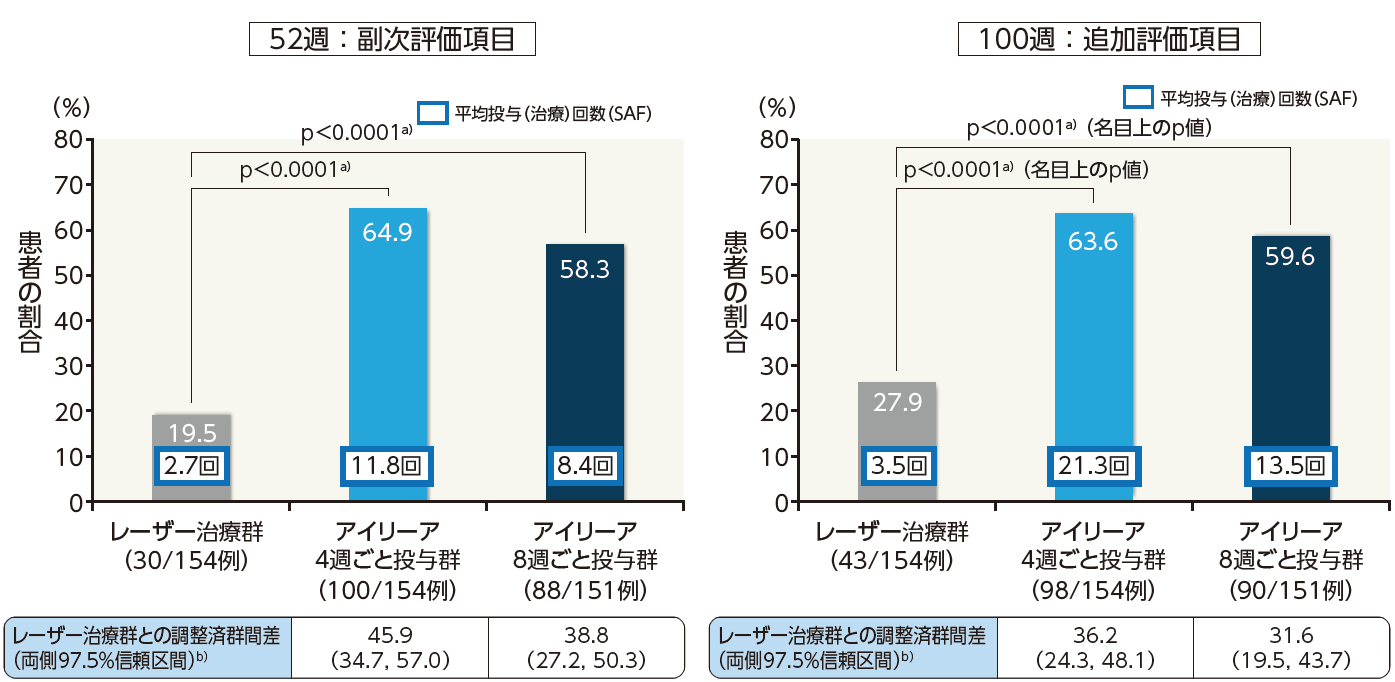
52週目における最高矯正視力文字数でベースラインから10文字以上の視力改善がみられた患者の割合は、アイリーア4週ごと投与群で64.9%、8週ごと投与群で58.3%であり、いずれもレーザー治療群の19.5%に対して優越性が示されました。また、52週目における最高矯正視力文字数でベースラインから15文字以上の視力改善がみられた患者の割合においても、アイリーア4週ごと投与群で41.6%、8週ごと投与群で31.1%と、いずれもレーザー治療群の7.8%に対して優越性が示されました。
10文字以上の視力改善がみられた患者の割合(LOCF、FAS)
- a)
- 心筋梗塞または脳血管障害の既往歴で調整した両側CMH検定
- b)
- 各アイリーア投与群-レーザー治療群(心筋梗塞または脳血管障害の既往歴を層としたCMH型の重みを用いて調整した)
15文字以上の視力改善がみられた患者の割合(LOCF、FAS)

- a)
- 心筋梗塞または脳血管障害の既往歴で調整した両側CMH検定
- b)
- 各アイリーア投与群-レーザー治療群(心筋梗塞または脳血管障害の既往歴を層としたCMH型の重みを用いて調整した)
その他の評価
【参考情報】糖尿病網膜症の重症度
52週目におけるETDRS糖尿病網膜症の重症度スコアが2段階以上低下した患者の割合は、アイリーア4週ごと投与群で33.8%、8週ごと投与群で29.1%であり、いずれもレーザー治療群(14.3%)に対して優越性が示されました。
ETDRS糖尿病網膜症の重症度スコアが2段階以上低下した患者の割合(LOCF、FAS)

- a)
- 心筋梗塞または脳血管障害の既往歴で調整した両側CMH検定
- b)
- 各アイリーア投与群-レーザー治療群(心筋梗塞または脳血管障害の既往歴を層としたCMH型の重みを用いて調整した)
形態学的評価
中心網膜厚(CRT)の変化
52週目におけるCRTのベースラインからの変化量は、アイリーア4週ごと投与群で-185.9μm、8週ごと投与群で-183.1μmであり、いずれのアイリーア投与群もレーザー治療群の-73.3μmに対して優越性が示されました。また、100週目におけるCRTのベースラインからの変化量は、アイリーア4週ごと投与群で-191.4μm、8週ごと投与群で-191.1μmであり、レーザー治療群で-83.9μmでした。
CRTの変化量の推移(LOCF、FAS)

- a)
- 治療群および心筋梗塞または脳血管障害の既往歴を固定効果、CRTのベースライン値を共変量としたANCOVAモデル
- b)
- 各アイリーア投与群-レーザー治療群
QOLに関する評価
(1)【参考情報】NEI VFQ-25の「近見視力による行動」サブスケールスコアの変化
52週目におけるNEI VFQ-25の「近見視力による行動」サブスケールスコアのベースラインからの変化量は、アイリーア4週ごと投与群で9.0ポイント、8週ごと投与群で9.4ポイントであり、いずれもレーザー治療群の5.4ポイントに対して優越性が示されました。
NEI VFQ-25「近見視力による行動」サブスケールスコアの変化量(LOCF、FAS)

- a)
- 治療群および心筋梗塞または脳血管障害の既往歴を固定効果、NEI VFQ-25「近見視力による行動」サブスケールスコアのベースライン値を共変量としたANCOVAモデル
- b)
- 各アイリーア投与群-レーザー治療群
(2)【参考情報】NEI VFQ-25の「遠見視力による行動」サブスケールスコアの変化
52週目におけるNEI VFQ-25の「遠見視力による行動」サブスケールスコアのベースラインからの変化量は、アイリーア4週ごと投与群で8.6ポイント、8週ごと投与群で7.3ポイントであり、レーザー治療群の6.7ポイントに対して優越性は示されませんでした。
NEI VFQ-25「遠見視力による行動」サブスケールスコアの変化量(LOCF、FAS)

- a)
- 治療群および心筋梗塞または脳血管障害の既往歴を固定効果、NEI VFQ-25「遠見視力による行動」サブスケールスコアのベースライン値を共変量としたANCOVAモデル
- b)
- 各アイリーア投与群-レーザー治療群
安全性(52週間の有害事象発現率)
VISTA-DME試験(52週間)において、すべての有害事象はアイリーア4週ごと投与群で155例中142例(91.6%)、8週ごと投与群で152例中139例(91.4%)、レーザー治療群で154例中146例(94.8%)に認められました。主な有害事象は、アイリーア4週ごと投与群で結膜出血60例(38.7%)、高血圧38例(24.5%)、眼痛23例(14.8%)、硝子体浮遊物19例(12.3%)、8週ごと投与群で結膜出血45例(29.6%)、高血圧28例(18.4%)、眼痛19例(12.5%)、黄斑線維症17例(11.2%)、レーザー治療群で結膜出血55例(35.7%)、高血圧34例(22.1%)などでした。
安全性(100週間の有害事象発現率)
VISTA-DME試験(100週間)において、すべての有害事象はアイリーア4週ごと投与群で155例中152例(98.1%)、8週ごと投与群で152例中148例(97.4%)、レーザー治療群で154例中150例(97.4%)に認められました。試験薬に関連する重篤な有害事象は、アイリーア4週ごと投与群で脳幹卒中・脳血管発作・心停止が各1例、アイリーア8週ごと投与群で眼圧上昇・脳血管発作が各1例、レーザー治療群で脳血管発作が1例に認められました。試験薬に関連する投与中止に至った有害事象は、アイリーア4週ごと投与群で脳幹卒中が1例に認められました。試験薬に関連する死亡は、アイリーア4週ごと投与群で心停止・脳血管発作が各1例に認められました。
VISTA-DME試験(100週間)

発現例数(発現率%)
- a)
- すべての有害事象のうち、APTC(Antiplatelet Trialists' Collaboration)定義により判定された動脈血栓塞栓事象



