国内第Ⅲ相試験:VIVID-Japan試験1)
(日本人患者の安全性の確認)
1)バイエル薬品社内資料[国内第Ⅲ相試験:VIVID-Japan試験]承認時評価資料
本ページでは「アイリーア(2mg)」を「アイリーア」と記載しています。
VIVID-DME試験でアイリーア投与を受けた日本人集団は51例(アイリーア4週ごと投与群:26例、8週ごと投与群:25例)と少数であったことから、日本人の糖尿病黄斑浮腫(DME)を有する患者に対するアイリーア硝子体内投与の安全性評価の確認を主目的とし、日本国内(17施設)においてアイリーア2mg単一群による多施設共同非無作為化非遮蔽試験(第Ⅲ相試験)を実施しました。
試験概要
目的
DMEを有する日本人患者に対するアイリーアの硝子体内投与の安全性および忍容性を検討するとともに、有効性についても検討する。
試験対象
DMEを有する患者:73例
[主な選択基準]
1型あるいは2型糖尿病を有する18歳以上の男女かつ
- 試験眼に、黄斑の中心窩(OCTで測定される黄斑の中心部領域)に及ぶDMEを有する
- 試験眼にDMEが原因の視力低下を有する
- 試験眼のOCTによる網膜厚が300µm以上
- スクリーニング時における試験眼のETDRS視力表による最高矯正視力文字数が73~24文字(スネレン視力で20/40~20/320)など
試験デザイン
非無作為化非遮蔽単一群試験
投与方法
対象患者に、アイリーア2mgを0~16週目まで4週ごとに5回投与し〔0週目(1日目)、4、8、12、16週目〕、その後48週まで8週ごとに硝子体内投与を行い、52週目に最終評価を行った。
主な評価項目
安全性(主要評価項目、SAF)
有害事象、副作用、重篤な有害事象、投与中止に至った有害事象、死亡、APTC定義による動脈血栓塞栓事象 など
有効性
52週目における最高矯正視力文字数のベースラインからの変化量(FAS)
52週目における中心網膜厚(CRT)のベースラインからの変化量(FAS) など
OCT(optical coherence tomography):光干渉断層計
SAF(safety analysis set):安全性解析対象集団
FAS(full analysis set):最大の解析対象集団
- 中心網膜厚(CRT:central retinal thickness):中心サブフィールド(中心窩から直径1mmの範囲)の網膜厚
糖尿病黄斑浮腫の用法及び用量
アフリベルセプト(遺伝子組換え)として2mg(0.05mL)を1ヵ月ごとに1回、連続5回硝子体内投与する。その後は、通常、2ヵ月ごとに1回、硝子体内投与する。なお、症状により投与間隔を適宜調節するが、1ヵ月以上あけること。
患者背景および特性(FAS)

平均値±標準偏差(性別、糖尿病コントロール以外)
安全性(52週間の有害事象発現率)
VIVID-Japan試験(52週間)において、すべての有害事象は72例中57例(79.2%)に認められました。主な有害事象は、鼻咽頭炎9例(12.5%)などでした。試験薬に関連する重篤な有害事象は、急性心筋梗塞・腎不全が1例(同一症例)に認められ、試験薬に関連する投与中止に至った有害事象は、急性心筋梗塞が1例に認められました。試験薬に関連する死亡は認められませんでした(主要評価項目、SAF)

発現例数(発現率%)
- a)
- すべての有害事象のうち、APTC(Antiplatelet Trialists’ Collaboration)定義により判定された動脈血栓塞栓事象
視力評価
視力の変化
52週目での最高矯正視力文字数のベースラインからの変化量は+9.3文字でした。
最高矯正視力文字数の変化量の推移(LOCF、FAS)
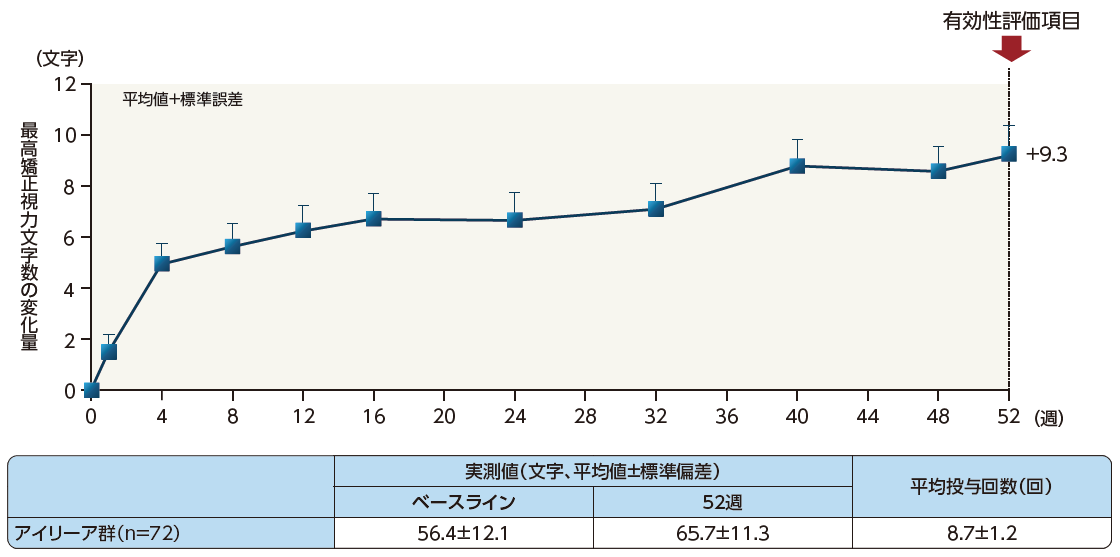
LOCF(last observation carried forward):最終評価スコア外挿法
形態学的評価
中心網膜厚(CRT)の変化
52週目におけるCRTのベースラインからの変化量は-202.0μmでした。
CRTの変化量の推移(LOCF、FAS)

安全性併合解析(1年間)
国内外で実施された第Ⅲ相試験3試験※1の安全性併合解析(1年間)の結果、アイリーア2mgを投与された730例※2中276例(37.8%)に副作用※3が認められました。主な副作用は、結膜出血178例(24.4%)、眼痛51例(7.0%)、硝子体浮遊物33例(4.5%)でした。うちアイリーアを投与された日本人症例128例(アイリーア群123例、レーザー治療群5例)中35例(27.3%)に副作用が認められました。主な副作用は、結膜出血23例(18.0%)でした。(効能追加承認時)
- ※1
- VIVID-DME試験、VISTA-DME試験、VIVID-Japan試験
- ※2
- アイリーア2mgを投与された症例(アイリーア群650例、レーザー治療群80例)を評価対象とした
- ※3
- 投与手技に起因する有害事象を含む



