患者さんの負担とニーズを考慮した持続可能なDME治療を目指して

施設での幾つかの場面における患者さんのニーズや負担に関連するデータをご紹介しています。
DME(diabetic macular edema):糖尿病黄斑浮腫
アイリーア8mgの承認された効能又は効果(抜粋):糖尿病黄斑浮腫
Sustainable Disease Control(SDC)
黄斑疾患治療において、疾患活動性を示す血管新生や血管透過性亢進などの病態を持続してコントロールし、長期的に視力低下を防ぐことが重要であり、SDCとはその治療達成を目指した治療目標です。

監修:鹿児島大学 名誉教授 坂本 泰二 先生
日本人を含む第Ⅱ/Ⅲ相国際共同試験:
PHOTON試験(アフリベルセプト2mgに対する非劣性の検証)

バイエル薬品社内資料[日本人を含む第Ⅱ/Ⅲ相国際共同試験:PHOTON試験]承認時評価資料、電子添文改訂時評価資料(96週)
Do DV, et al.: Ophthalmology. 2025. Epub ahead of print.
試験概要
【実施地域】日本、欧州、北米の7ヵ国、138施設
目的
DME患者を対象に、アイリーア8mg12週間隔または16週間隔投与による有効性についてアフリベルセプト2mg8週間隔投与に対する非劣性を検証するとともに、安全性についても検討する
試験対象
DME患者660例(うち日本人:74例)
[主な選択基準]
- 試験眼においてスクリーニング来院時に読影施設で測定したCRTがSD-OCTで300μm以上(またはSpectralis SD-OCTで320μm以上)、中心窩に及ぶDMEを有する、1型または2型糖尿病の18歳以上の男女
- 試験眼のETDRS視力表による最高矯正視力文字数が78~24文字(スネレン視力で20/32~20/320)であり、視力低下の主な原因がDMEである など
[主な除外基準]
- いずれかの眼に糖尿病以外の原因による黄斑浮腫が認められる
- 試験眼に活動性の増殖糖尿病網膜症が認められる
- スクリーニング来院前12週以内に試験眼に汎網膜光凝固術または黄斑光凝固術による治療歴を有する
- スクリーニング来院前12週以内に試験眼に抗VEGF薬の硝子体内投与による治療歴を有する
- スクリーニング来院前16週以内に試験眼に副腎皮質ステロイドの眼内投与または眼周囲投与、あるいは時期を問わず副腎皮質ステロイドの硝子体内インプラント※1による治療歴を有する
- 試験眼に網膜硝子体手術(強膜バックリングを含む)による治療歴を有する
- 試験眼の眼圧が25mmHg以上
- 試験眼に特発性または自己免疫性ぶどう膜炎の既往歴を有する
- スクリーニング来院前12週以内に、いずれかの眼に、眼内の炎症または感染を有する
- コントロール不良の糖尿病(HbA1c 12%超)を有する
- コントロール不良の高血圧(収縮期血圧160mmHg超または拡張期血圧95mmHg超)を有する
- スクリーニング来院前24週以内に脳血管発作または心筋梗塞の既往歴を有する
- 腎不全、透析または腎移植歴を有する など
※1 本邦において未承認かつ未発売
試験デザイン
無作為化二重遮蔽実薬対照比較試験
投与方法
対象患者をアフリベルセプト2mg8週間隔投与群、アイリーア8mg12週間隔投与群、アイリーア8mg16週間隔投与群の3群に1:2:1の比で無作為に割り付け※2、硝子体内投与した。試験薬の投与は片眼のみに実施した。
- 2mg8週間隔投与群:アフリベルセプト2mgを4週間隔で連続5回投与後、8週間隔で投与
- 8mg12週間隔投与群:アイリーア8mgを4週間隔で連続3回投与後、12週間隔で投与
- 8mg16週間隔投与群:アイリーア8mgを4週間隔で連続3回投与後、16週間隔で投与
8mg12週間隔投与群および16週間隔投与群の試験薬投与の詳細は、下部の「投与スケジュール、用法用量の変更」を参照のこと。
※2 ベースラインのCRT(400μm未満、400μm以上)、過去のDME治療(あり、なし)および地域(日本、その他の地域)に基づき層別化した。
主な有効性評価項目
主要評価項目:
48週目における最高矯正視力文字数のベースラインからの変化量
主な副次評価項目:
60週目における最高矯正視力文字数のベースラインからの変化量 など
その他の副次評価項目:
48週目におけるCRTのベースラインからの変化量 など
探索的評価項目:
96週目における最高矯正視力文字数のベースラインからの変化量
8mg12週間隔投与群において48週目および96週目まで投与間隔が12週間隔以上であった患者の割合
8mg16週間隔投与群において48週目および96週目まで投与間隔が16週間隔以上であった患者の割合
その他の副次評価項目(48週目の評価)に設定した評価項目の60週目および96週目の評価 など
主な安全性評価項目
有害事象、副作用、重篤な有害事象、投与中止に至った有害事象、死亡、眼内炎症反応、眼圧上昇事象、眼圧上昇の程度、高血圧事象、APTC定義による動脈血栓塞栓事象 など
事前に規定されたその他の評価項目
• 8mg12週間隔投与群において96週目に次回予定された投与間隔が12週間隔以上であった患者の割合
• 8mg16週間隔投与群において96週目に次回予定された投与間隔が16週間隔以上であった患者の割合
• 48週目および96週目までの投与回数 など
解析計画
主要評価項目および主な副次評価項目において、検定全体のfamily-wiseの第1種の過誤確率を0.025(片側検定)に制御した。主要評価項目および主な副次評価項目における検定の多重性の調整には、下記の階層的検定手順を用い、より上位の階層にランク付けされた仮説を棄却した後にのみ、有意水準0.025(片側)で続く下位の仮説の検定を可能とした※3。

いずれも2mg8週間隔投与群に対する比較検定
階層的検定手順に基づく仮説はすべての患者が60週目を完了(または早期中止)した後に評価した。
主要評価項目を含む48週目までの有効性評価について、60週目完了後のデータによる再解析は実施しなかった。
※3 ⑥において非劣性が示されなかったため、検定を終了した。
検証的な解析(第1種の過誤を考慮し、検出力を考慮し例数設計された解析)
主要評価項目(FAS):
8mg12週間隔投与群および8mg16週間隔投与群の2mg8週間隔投与群に対する非劣性の検証(非劣性限界値-4文字)
第1種の過誤を考慮した解析(検出力を考慮した例数設計はされていない)
主な副次評価項目(FAS):
「60週目における最高矯正視力文字数のベースラインからの変化量」は主要評価項目と同一の方法により解析
探索的な解析
その他の副次評価項目(FAS)、探索的評価項目(FAS、SAF)、事前に規定されたその他の評価項目(SAF)
利益相反
Do DV, et al.: Ophthalmology. 2025. Epub ahead of print.
本研究はRegeneronおよびBayerの資金提供により実施され、両社は試験デザイン作成、データ収集、データ解析、原稿作成などに関与した。
著者のうち9名はRegeneronの社員、7名はBayerの社員であり、その他の著者にBayer、Regeneronまたは参天製薬から研究資金等を受領している者が含まれる。
CRT(central retinal thickness):中心網膜厚、SD-OCT(spectral domain optical coherence tomography):スペクトラルドメイン光干渉断層撮影、
ETDRS(Early Treatment Diabetic Retinopathy Study):糖尿病網膜症早期治療研究、APTC(Antiplatelet Trialists’ Collaboration)、
DRSS(diabetic retinopathy severity scale):糖尿病網膜症重症度尺度
● 中心網膜厚:中心窩領域(中心窩から直径1mmの範囲)の網膜厚
● FAS(full analysis set):最大の解析対象集団。無作為化され、少なくとも1回の試験薬投与を受けたすべての患者。無作為割り付けされた群に基づき解析を行った。
● SAF(safety analysis set):安全性解析対象集団。無作為化され、少なくとも1回の試験薬投与を受けたすべての患者。実際の投与に基づき解析を行った。
投与スケジュール、用法用量の変更
8mg12週間隔投与群および16週間隔投与群では、16週目以降、DRM基準に従い投与間隔を変更した。

DRM(dose regimen modification):用法用量変更
DRM基準(短縮:16週目以降):
「DMEの遷延または悪化による最高矯正視力文字数の12週目からの10文字超低下」かつ「CRTの12週目からの50μm超増加」
DRM基準(延長:52週目以降):
「最高矯正視力文字数の12週目からの低下が5文字未満」かつ「CRTがOCTで300μm未満※」
※ SD-OCTで300μm未満(Spectralis SD-OCTでは320μm未満)
投与間隔の短縮および延長の基準のいずれも満たさなかった患者は投与間隔を維持した。
糖尿病黄斑浮腫の用法及び用量
アフリベルセプト(遺伝子組換え)として8mg(0.07mL)を4週ごとに1回、通常、連続3回(導入期)硝子体内投与するが、症状により投与回数を適宜減じる。その後の維持期においては、通常、16週ごとに1回、硝子体内投与する。なお、症状により投与間隔を適宜調節するが、8週以上あけること。
Focus on Vision Gain
主要評価項目
(検証的解析結果)
48週目における最高矯正視力文字数のベースラインからの変化量は、8mg12週間隔投与群で+8.1文字、8mg16週間隔投与群で+7.2文字であり、2mg8週間隔投与群(+8.7文字)に対する非劣性が検証されました
最高矯正視力文字数のベースラインからの変化量(MMRM、FAS)
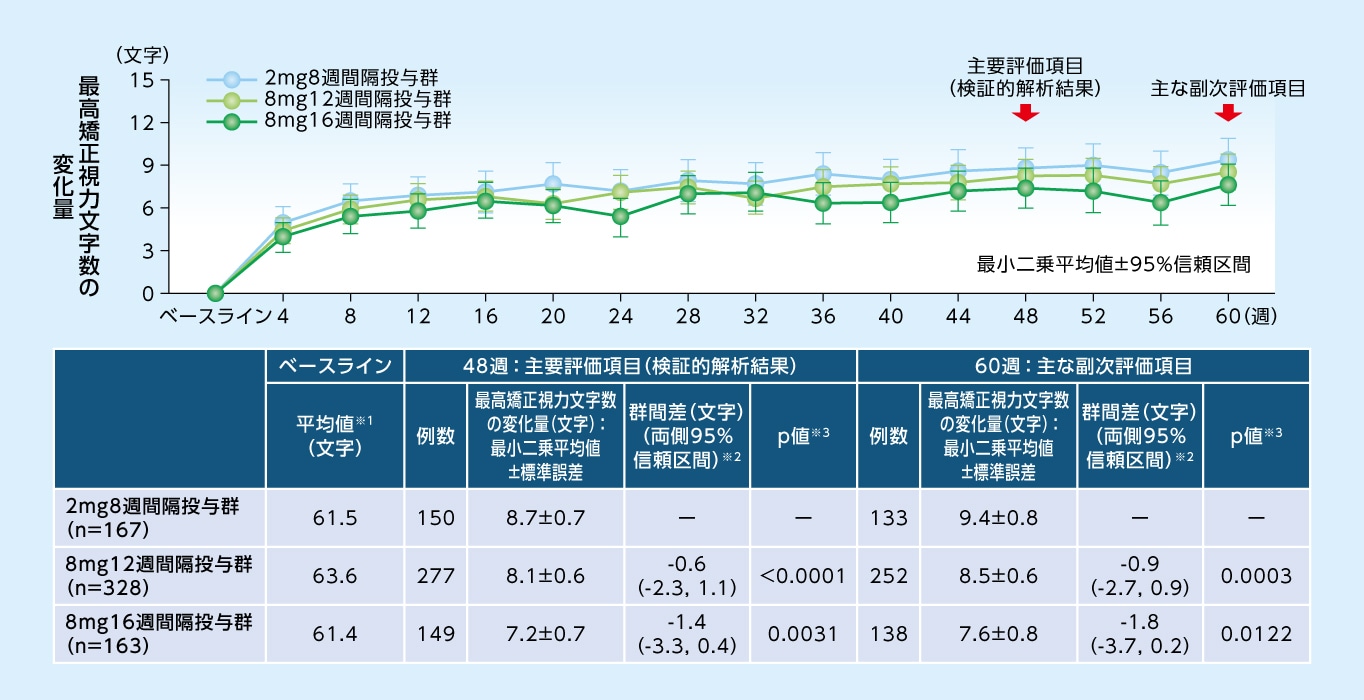
※1 実測値 ※2 各群ー2mg8週間隔投与群 ※3 非劣性(非劣性限界値-4文字)の片側検定
●
MMRM(mixed model for repeated measurements):反復測定混合効果モデル。ベースラインの最高矯正視力文字数を共変量、投与群、来院および層別因子[ベースラインのCRT(400μm未満、400μm以上)、過去のDME治療(あり、なし)および地域(日本、その他の地域)]を固定効果とし、ベースラインの最高矯正視力文字数と来院の交互作用項、投与群と来院の交互作用項を含む。
探索的評価項目
96週目における最高矯正視力文字数のベースラインからの変化量は、8mg12週間隔投与群で+8.2文字、8mg16週間隔投与群で+6.6文字、2mg8週間隔投与群で+7.7文字でした
最高矯正視力文字数のベースラインからの変化量(MMRM、FAS)
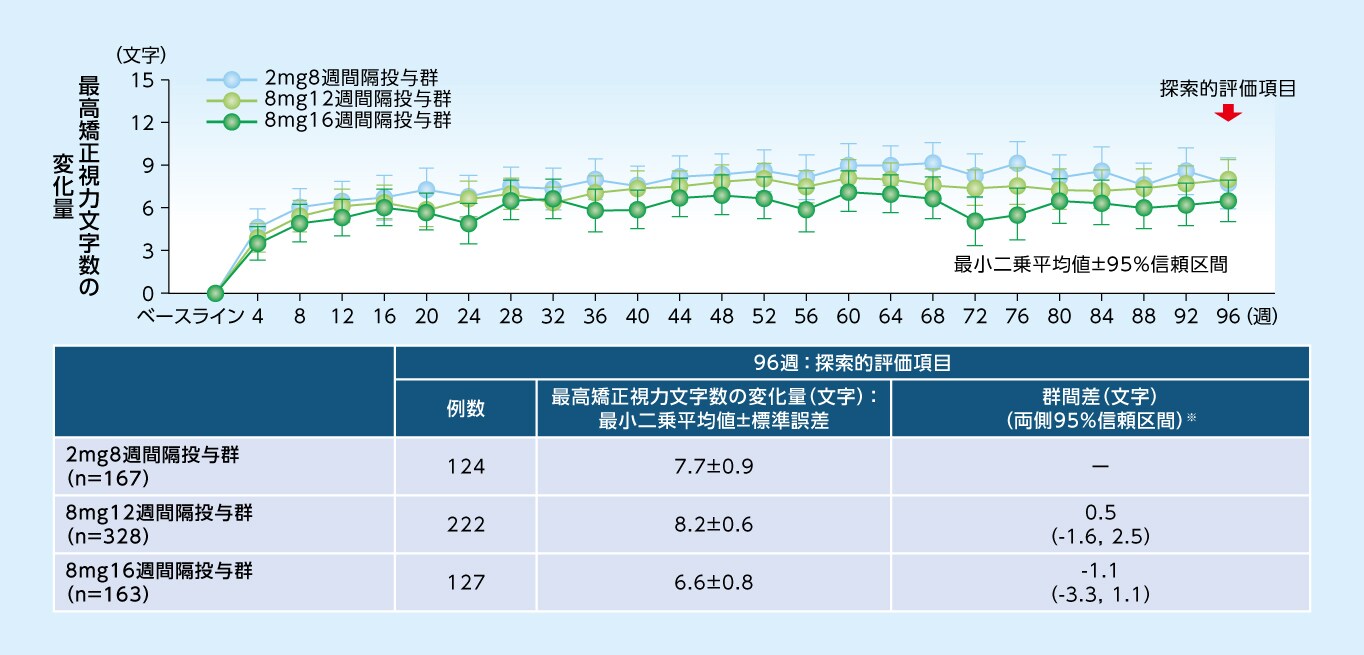
※ 各群ー2mg8週間隔投与群
●
MMRM:ベースラインの最高矯正視力文字数を共変量、投与群、来院および層別因子[ベースラインのCRT(400μm未満、400μm以上)、過去のDME治療(あり、なし)および地域(日本、その他の地域)]を固定効果とし、ベースラインの最高矯正視力文字数と来院の交互作用項、投与群と来院の交互作用項を含む。
バイエル薬品社内資料[日本人を含む第Ⅱ/Ⅲ相国際共同試験:PHOTON試験]承認時評価資料、電子添文改訂時評価資料(96週)
Focus on Fluid Status
その他の
副次評価項目
48週目におけるCRTのベースラインからの変化量は、8mg12週間隔投与群で-176.8μm、8mg16週間隔投与群で-148.8μm、2mg8週間隔投与群で-164.9μmでした
CRTのベースラインからの変化量(MMRM、FAS)
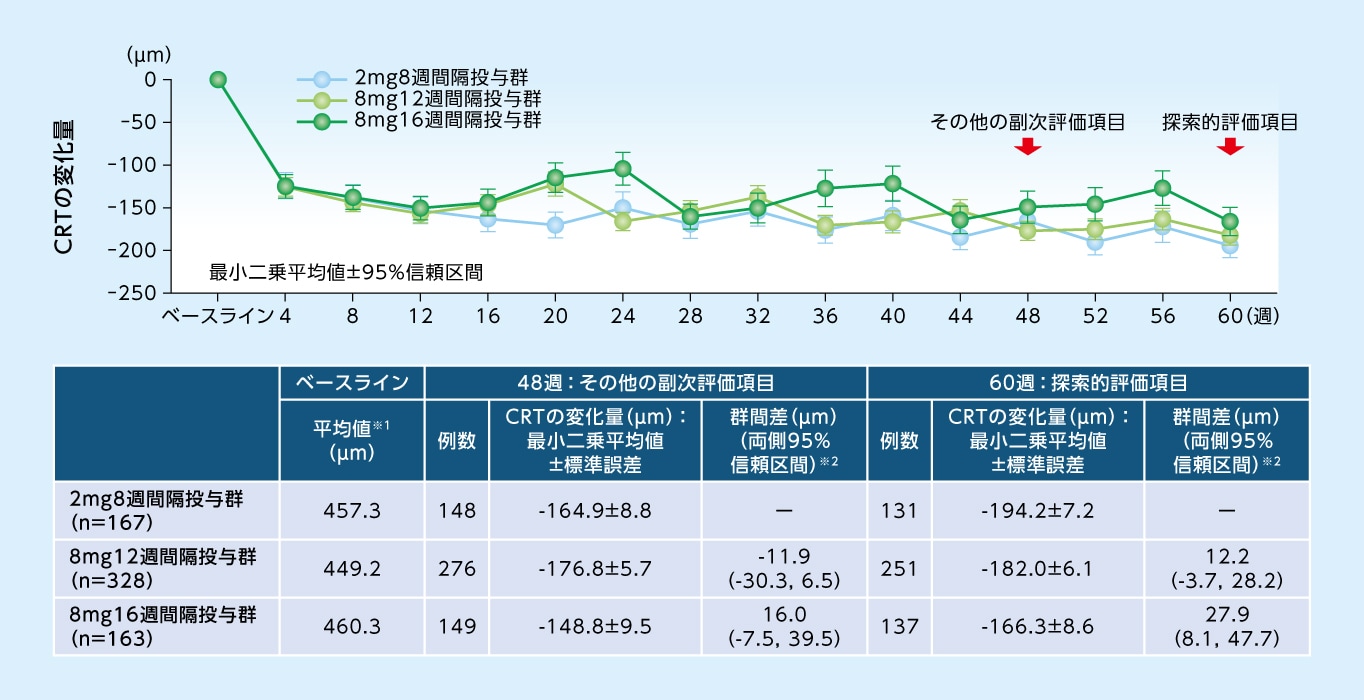
※1 実測値 ※2 各群ー2mg8週間隔投与群
●
MMRM:ベースラインのCRTを共変量、投与群、来院および層別因子[ベースラインのCRT(400μm未満、400μm以上)、過去のDME治療(あり、なし)および地域(日本、 その他の地域)]を固定効果とし、ベースラインのCRTと来院の交互作用項、投与群と来院の交互作用項を含む。
探索的評価項目
96週目におけるCRTのベースラインからの変化量は、8mg12週間隔投与群で-194.0μm、8mg16週間隔投与群で-158.4μm、2mg8週間隔投与群で-191.3μmでした
CRTのベースラインからの変化量(MMRM、FAS)
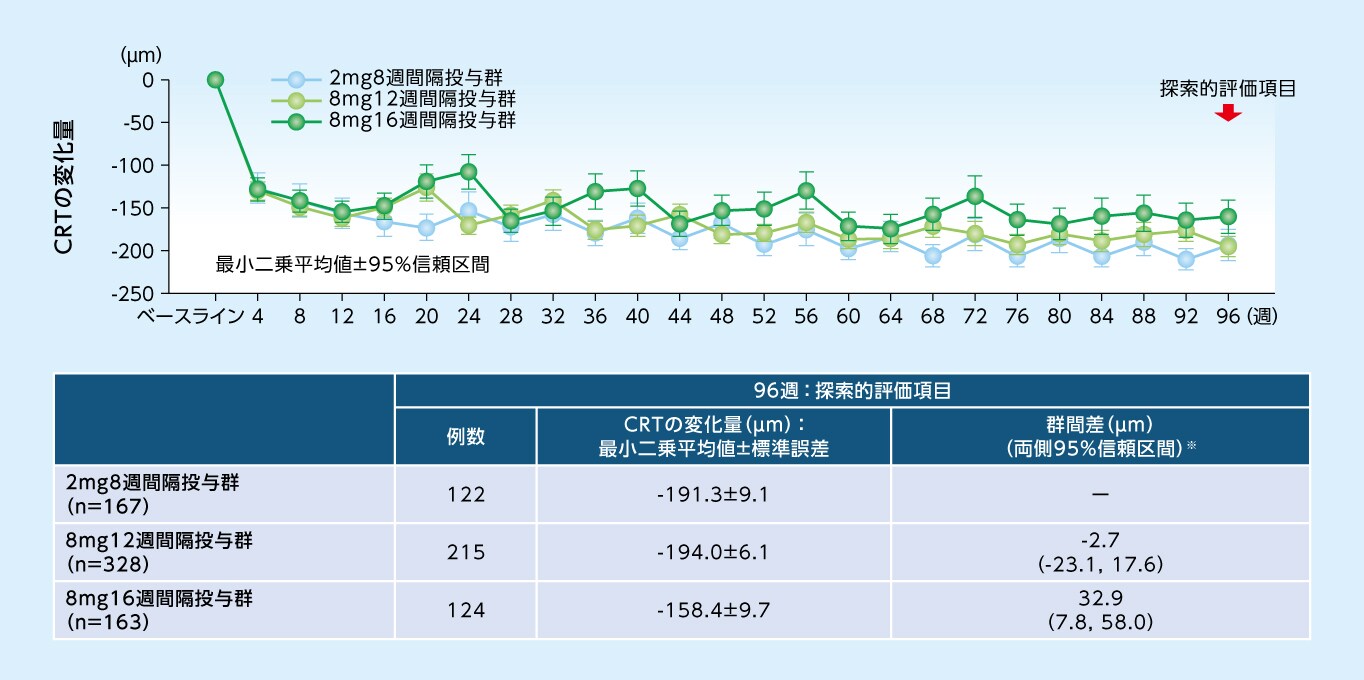
※ 各群ー2mg8週間隔投与群
●
MMRM:ベースラインのCRTを共変量、投与群、来院および層別因子[ベースラインのCRT(400μm未満、400μm以上)、過去のDME治療(あり、なし)および地域(日本、その他の地域)]を固定効果とし、ベースラインのCRTと来院の交互作用項、投与群と来院の交互作用項を含む。
バイエル薬品社内資料[日本人を含む第Ⅱ/Ⅲ相国際共同試験:PHOTON試験]承認時評価資料、電子添文改訂時評価資料(96週)
Focus on Treatment Burden
事前に規定された
その他の評価項目
8mg12週間隔投与群において96週目に次回予定された投与間隔が12週間隔以上であった患者の割合は91.8%、20週間隔以上であった患者の割合は43.0%でした
8mg12週間隔投与群において96週目に次回予定された投与間隔別の患者の割合※1(SAF※2)1,2)
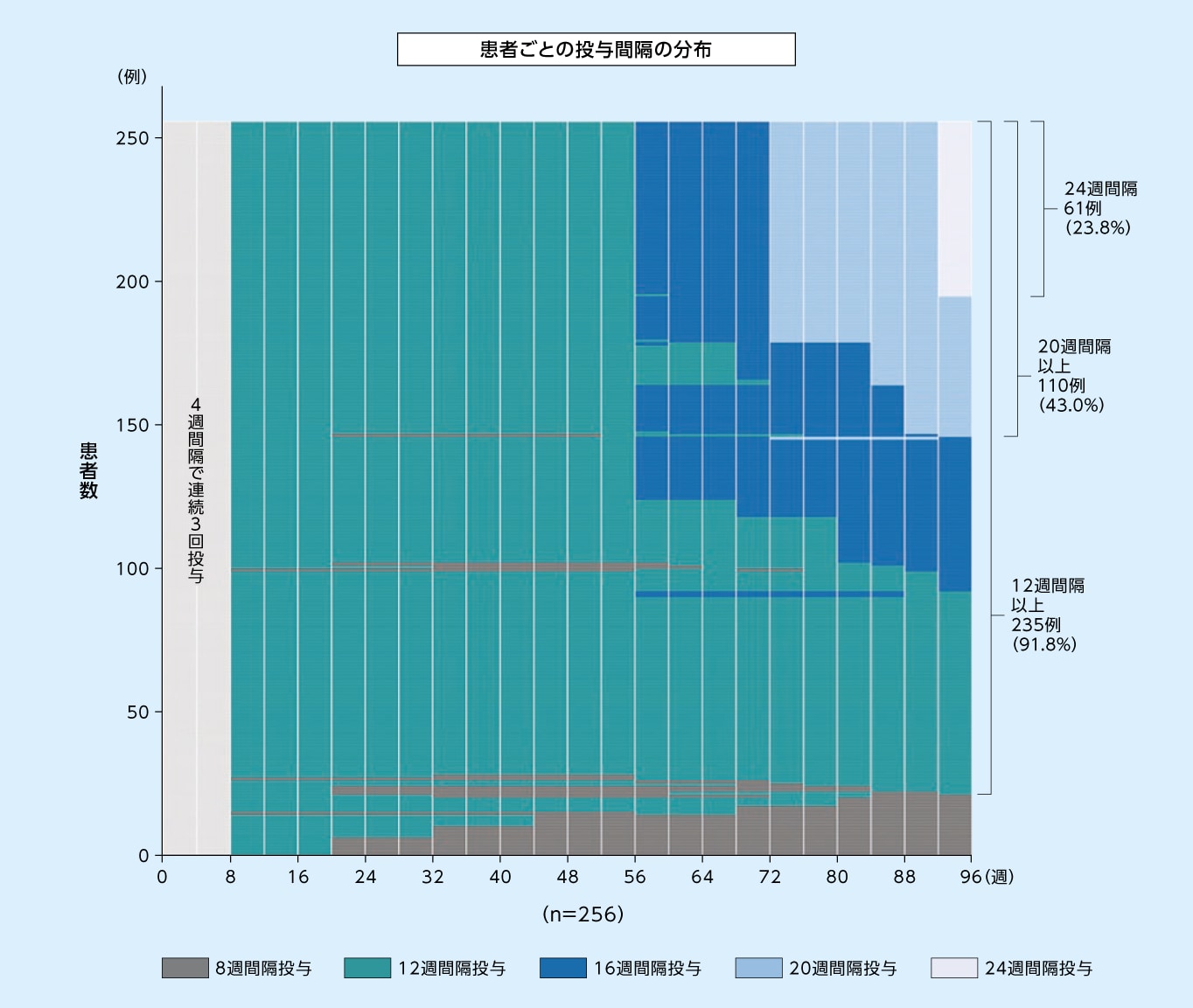
縦の白線は来院を示す
※1
96週目より前の最終来院日における評価に基づく投与間隔(すなわち92週目までの最終来院日における評価に基づく投与間隔)
※2
SAFのうち96週目までの投与を完了した患者のみ
8mg12週間隔投与群において96週目まで投与間隔が12週間隔以上であった患者の割合(SAF※)(探索的評価項目)2)

※ SAFのうち96週目までの投与を完了した患者のみ
1)Do DV, et al.: Ophthalmology. 2025. Epub ahead of print. より改変
2)バイエル薬品社内資料[日本人を含む第Ⅱ/Ⅲ相国際共同試験:PHOTON試験]電子添文改訂時評価資料(96週)
事前に規定された
その他の評価項目
8mg16週間隔投与群において96週目に次回予定された投与間隔が16週間隔以上であった患者の割合は87.8%、20週間隔以上であった患者の割合は46.8%でした
8mg16週間隔投与群において96週目に次回予定された投与間隔別の患者の割合※1(SAF※2)1,2)
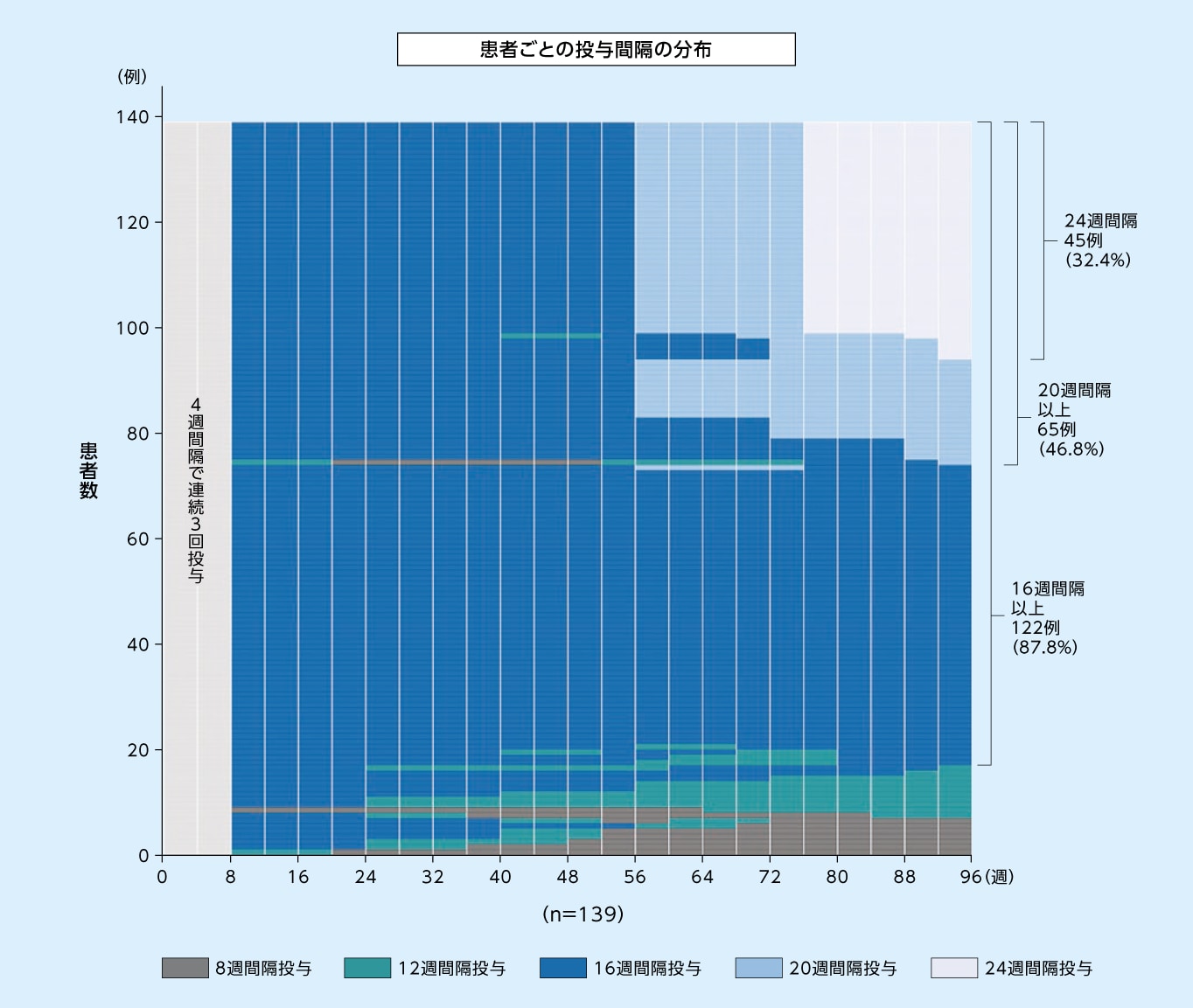
縦の白線は来院を示す
※1
96週目より前の最終来院日における評価に基づく投与間隔(すなわち92週目までの最終来院日における評価に基づく投与間隔)
※2
SAFのうち96週目までの投与を完了した患者のみ
8mg16週間隔投与群において96週目まで投与間隔が16週間隔以上であった患者の割合(SAF※)(探索的評価項目)2)

※ SAFのうち96週目までの投与を完了した患者のみ
1)Do DV, et al.: Ophthalmology. 2025. Epub ahead of print. より改変
2)バイエル薬品社内資料[日本人を含む第Ⅱ/Ⅲ相国際共同試験:PHOTON試験]電子添文改訂時評価資料(96週)
事前に規定された
その他の評価項目
試験眼に対する96週目までの投与回数は、8mg12週間隔投与群で8.6回、8mg16週間隔投与群で7.5回、2mg8週間隔投与群で12.9回でした
48週目および96週目までの投与回数※(試験眼、SAF)
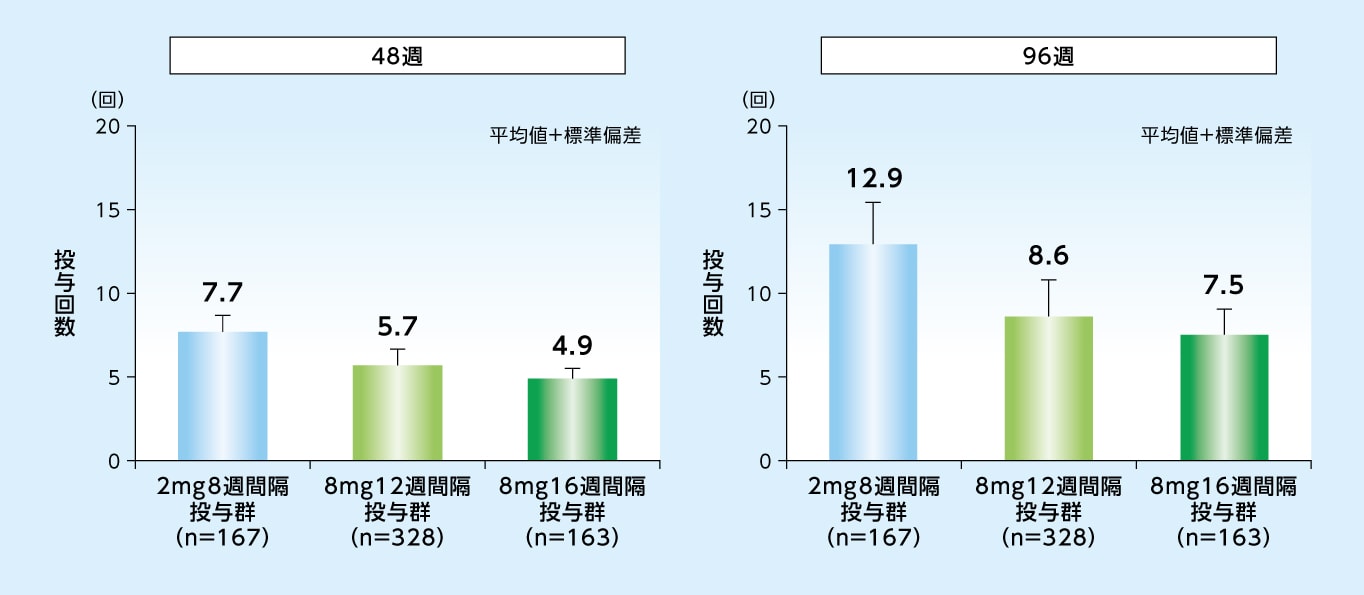
※ 偽注射を除く投与回数
バイエル薬品社内資料[日本人を含む第Ⅱ/Ⅲ相国際共同試験:PHOTON試験]承認時評価資料、電子添文改訂時評価資料(96週)
Safety
96週間において、すべての有害事象は8mg12週間隔投与群で328例中277例(84.5%)、8mg16週間隔投与群で163例中143例(87.7%)、2mg8週間隔投与群で167例中134例(80.2%)に認められました
有害事象(96週間、SAF)
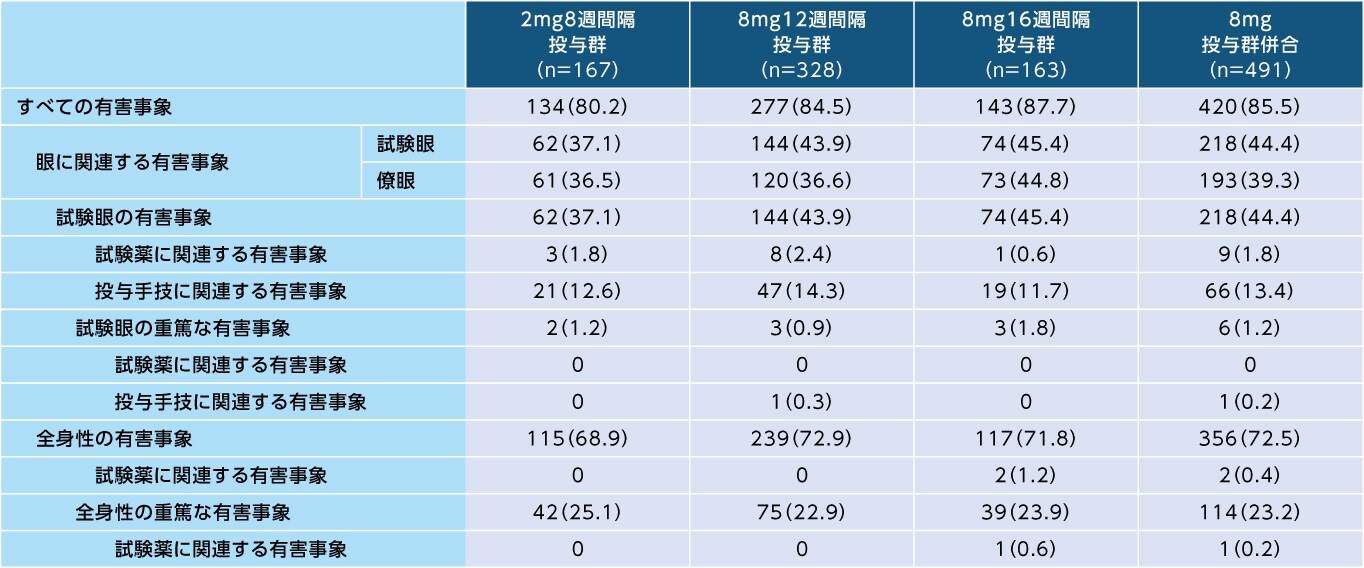
発現例数(発現割合%)
96週間において、各群の主な有害事象、試験薬に関連する重篤な有害事象、試験薬に関連する投与中止に至った有害事象、試験薬に関連する死亡は以下の通りでした
主な有害事象(96週間、SAF)
8mg12週間隔投与群:
COVID-19 44例(13.4%)、高血圧36例(11.0%)、上咽頭炎20例(6.1%)、硝子体浮遊物19例(5.8%)、白内障18例(5.5%)、結膜出血17例(5.2%)、硝子体剥離16例(4.9%)、貧血、頭痛が各13例(4.0%)、血圧上昇12例(3.7%)、糖尿病性網膜浮腫、背部痛が各11例(3.4%)、眼痛、急性心筋梗塞、高コレステロール血症、関節痛が各10例(3.0%) など
8mg16週間隔投与群:
高血圧31例(19.0%)、COVID-19 27例(16.6%)、白内障19例(11.7%)、貧血、上咽頭炎が各10例(6.1%)、下痢9例(5.5%)、結膜出血、悪心、糖尿病が各8例(4.9%)、ドライアイ、点状角膜炎、硝子体浮遊物、高コレステロール血症、関節痛が各7例(4.3%)、網膜出血、胃食道逆流性疾患、嘔吐、血圧上昇、高カリウム血症、咳嗽が各6例(3.7%)、糖尿病性網膜浮腫、硝子体剥離、硝子体出血、発熱、蜂巣炎、尿路感染、高脂血症、背部痛、急性腎障害が各5例(3.1%) など
2mg8週間隔投与群:
高血圧22例(13.2%)、COVID-19 15例(9.0%)、上咽頭炎、尿路感染が各9例(5.4%)、硝子体剥離、眼圧上昇、糖尿病が各7例(4.2%)、白内障、結膜出血、硝子体浮遊物、インフルエンザが各6例(3.6%)、糖尿病性網膜浮腫、霧視、貧血、冠動脈疾患、発熱、蜂巣炎、敗血症、背部痛、急性腎障害、慢性腎臓病、急性呼吸不全が各5例(3.0%) など
試験薬に関連する重篤な有害事象(96週間、SAF)
8mg12週間隔投与群:本試験においては認められなかった
8mg16週間隔投与群:脳血管発作1例
2mg8週間隔投与群:本試験においては認められなかった
試験薬に関連する投与中止に至った有害事象(96週間、SAF)
8mg12週間隔投与群:虹彩炎、硝子体炎が各1例
8mg16週間隔投与群:本試験においては認められなかった
2mg8週間隔投与群:本試験においては認められなかった
試験薬に関連する死亡(96週間、SAF)
本試験においては認められなかった
MedDRA ver.26.0
バイエル薬品社内資料[日本人を含む第Ⅱ/Ⅲ相国際共同試験:PHOTON試験]、電子添文改訂時評価資料(96週)
まとめ
DME治療では、改善した視力を長期にわたり維持することを目指すこと、医療従事者と患者の治療にかかる負担とニーズを考慮し、持続可能な管理方法を選択することが重要であると考えられます
黄斑疾患治療において、疾患活動性を示す血管新生や血管透過性亢進などの病態を持続してコントロールし、長期的に視力低下を防ぐことが重要であり、SDCとはその治療達成を目指した治療目標です。

DME患者さんにおいて治療選択で最も重要な要因は「治療後に期待される視力」でした1)。
OCTによるFluidの観察は、網膜厚の測定とともに、臨床試験における疾患活動性の基準として使用されています2-4)。
Fluidの状況は、治療における有効性の評価、再投与判定の指標として用いられ、結果として再投与間隔の延長に影響する可能性があります2-4)。
抗VEGF薬注射の件数は、2010年から2021年にかけて約8.4倍に増加したと報告されています5)。
家族や友人の負担への懸念、頻回な治療回数、薬剤にかかる費用負担などは、DME患者さんの疾患の負担における主な課題として報告されています(海外データ) 6) 。
nAMDおよびDME患者さんの治療アドヒアランスの障壁として最も多く報告されたのは時間的負担(通院・待ち時間)であり、特に治療経過の長い患者さんで多く報告されました(海外データ) 7) 。
1)Hirano T, et al.: Ophthalmol Ther. 2024; 13: 2887-2901.
2)Khoramnia R, et al.: Eye (Lond). 2024; 38: 54-60.
3)Do DV, et al.: Ophthalmology. 2011; 118: 1819-1826.
4)Tatsumi T, et al.: Sci Rep. 2022; 12: 10672.
5)Chihara E.: Clin Ophthalmol. 2023; 17: 3131-3148.
6)Ziemssen F, et al.: Ophthalmol Ther. 2025; 14: 229-246
7)Müller S, et al.: Int J Retina Vitreous. 2021; 7: 43.
[PHOTON試験]
アイリーア8mgはPHOTON試験において、連続3回の導入期と最短8週最長24週の投与間隔による維持期の設定のもと96週目までの有効性が示されました
導入期からアイリーア8mgでDMEの治療を開始することでSDCの達成が期待できます
Focus on Vision Gain
96週目における最高矯正視力文字数のベースラインからの変化量(最小二乗平均値)は、8mg12週間隔投与群で+8.2文字、8mg16週間隔投与群で+6.6文字、2mg8週間隔投与群で+7.7文字でした。
Focus on Fluid Status
96週目におけるCRTのベースラインからの変化量(最小二乗平均値)は、8mg12週間隔投与群で-194.0μm、8mg16週間隔投与群で-158.4μm、2mg8週間隔投与群で-191.3μmでした。
Focus on Treatment Burden
8mg16週間隔投与群において96週目まで投与間隔が16週間隔以上であった患者の割合は83.5%であり、96週時点で、46.8%で次回予定された投与間隔を20週間隔以上に、32.4%で24週間隔に延長すると判断されていました。
Safety
96週間において、すべての有害事象は8mg12週間隔投与群で328例中277例(84.5%)、8mg16週間隔投与群で163例中143例(87.7%)、2mg8週間隔投与群で167例中134例(80.2%)に認められました。
96週間において、主な有害事象は8mg12週間隔投与群でCOVID-19 44例(13.4%)、高血圧36例(11.0%)、8mg16週間隔投与群で高血圧31例(19.0%)、COVID-19 27例(16.6%)、2mg8週間隔投与群で高血圧22例(13.2%)、COVID-19 15例(9.0%)などでした。
バイエル薬品社内資料[日本人を含む第Ⅱ/Ⅲ相国際共同試験:PHOTON試験]電子添文改訂時評価資料(96週)



